
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Титан и его сплавы
Титан — легкий (плотность 4,5) и тугоплавкий металл (tпл = 1725 °С).
Он сочетает достаточную прочность с высокой пластичностью и коррозионной стойкостью. Содержание титана в земной коре достигает 0,58 % и по своему распространению среди конструкционных металлов он находится на четвертом месте после алюминия, железа и магния.
ПДК в воде — 0,06 мг/л. Стандартный электродный потенциал титана для процесса Ti2+ + 2е ↔ Ti равен -1,63 В, а для процесса Ti3+ + Зе ↔ Ti равен -1,21 В. Таким образом, титан является термодинамически активным металлом. Однако титан склонен к пассивации и вследствие этого инертен во многих средах. Например, в морской воде при 25 °С потенциал титана близок к +0,09 В, т.е. положительнее, чем у цинка, железа, алюминия и меди в этой среде. Титан устойчив в средах, обладающих окислительными свойствами и содержащих хлорид-ионы. Так, титан устойчив в растворах: FeCl3 концентрации до 30 % и до 100 ° С, СuС12 — до 20 % и 100 ° С, HgCl2 всех концентраций до 100 ° С, А1С13 до 25% и до 60°С, NaCl всех концентраций до 100°С, в 100%-й хлоруксусной и дихлоруксусной кислотах до 100°С. Он устойчив в царской водке, растворах гипохлорита натрия до 100° С, хлорной воде, газообразном хлориде до 75 °С.
Таким образом, титан может применяться для изготовления аппаратов, насосов и коммуникаций для работы с указанными веществами. Титан стоек в азотной кислоте любых концентраций вплоть до температуры кипения. Скорость коррозии титана в дымящей азотной кислоте не превышает 0,1 мм/год.
В растворах соляной кислоты титан корродирует с выделением водорода. Он стоек только в разбавленных растворах НС1: при 60 ° С не выше 3% НС1, при 100 °С — не выше 0,5% НС1. С увеличением концентрации и повышением температуры соляной кислоты скорость коррозии увеличивается. Снизить скорость растворения Ti можно добавлением в раствор окислителей — К2Сr2О7, KMnO4, Η2O2, O2, ΗΝΟ3.
Титан растворяется в растворах плавиковой кислоты тем интенсивнее, чем выше концентрация кислоты.
При средних температурах (до 35 °С) титан стоек в растворах фосфорной кислоты концентрации до 30 %. При 100 °С титан начинает корродировать в Н3РО4 3 %-й концентрации.
Характер зависимости скорости растворения титана от концентрации серной кислоты имеет сложный характер. Отмечается два максимума скорости растворения — при концентрациях 40 % и 75 %. Исследователи связывают такое явление с изменением физико-химических свойств и электропроводности в системе H2SO4-H2O.
Сухой газообразный хлор вызывает сильную коррозию титана, так что возникает опасность воспламенения. При наличие в хлоре даже незначительных следов влаги порядка 0,005 %, коррозия титана в хлоре прекращается.
В разбавленных щелочах, до концентрации 20% NaOH, титан устойчив. В более концентрированных растворах и при нагреве он медленно реагирует с образованием соли титановой кислоты — Na2TiO3. 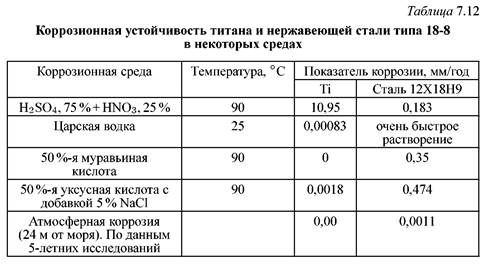
Титан обладает высокой коррозионной стойкостью во многих органических средах, в которых стали типа 12Х18Н9 корродируют (табл. 7.12).
Исключительное свойство титана — это его полная коррозионная устойчивость в морской воде и морской атмосфере.
Более высокие физико-механические и коррозионные свойства титана могут быть достигнуты при его легировании такими металлами, как А1, Мо, Та, Nb, Zn, Си и т.д.
Сплавы титана с алюминием имеют более высокую прочность и коррозионную стойкость, но они менее пластичны.
Сплавы системы титан-цирконий представляют собой однофазный твердый раствор. Эти сплавы обладают прочностью, пластичностью и коррозионной устойчивостью. Так, при введении в Ti 5 % Zr устойчивость сплава в 15 % растворе НС1 при 60 ° С повышается в 2 раза, а при введении 50 % Zr — в 160 раз.
У сплавов титан-молибден наблюдается высокая коррозионная стойкость в соляной, серной и фосфорной кислотах. Так, в 5%-м растворе Б^ SO4 при 100 ° С скорость коррозии Ti при добавлении 3 % Мо уменьшается в 23,5 раза, а при добавлении 5 % Мо — в 117,5 раза.
Сплавы титан-тантал обладают повышенной коррозионной стойкостью. Сплав титана с 5 % Та имеет высокую коррозионную стойкость в 18 %-й НС1 при 90 °С, при обязательном присутствии СЬ, как окислителя. Сплав титана с 20 % Та стоек в 5 %-й НС1 при 100 °С.
Титан и его сплавы применяются в химической промышленности для изготовления аппаратуры в производстве серной кислоты, хлора и ряда органических продуктов. Титан нашел промышленное применение в качестве основы для электродов ОРТА (окисныерутениевотитановые аноды) при электрохимическом производстве хлора, гипохлоритов, хлоратов.
При легировании титана палладием (от 0,01 % до 5,0%) и платиной повышается его коррозионная стойкость в растворах H2SO4, НС1, Н3РО4 и в органических кислотах.
Для существенного снижения скорости коррозии необходимо ввести в сплав (0,2-0,5)% Pd. Недостаточное легирование сплава палладием (0,05-0,1) % может привести к обратному эффекту — увеличению скорости его растворения.
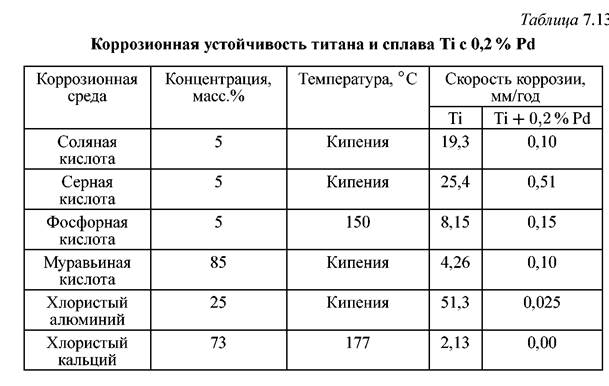
Титан, легированный палладием или платиной, как конструкционный материал для химической промышленности обладает редким и ценным сочетанием свойств — коррозионной стойкостью в окислительных и неокислительных кислых средах. В таблице 7.13 приведена сравнительная характеристика коррозионной стойкости титана и сплава титана с 0,2 % Pd.
>
Коррозионная стойкость сплава, как правило, устанавливается не сразу, а после некоторого взаимодействия с коррозионной средой, во время которого происходит обогащение поверхностного слоя сплава палладием или платиной.
 |
7.2.10. Тантал
Тантал—тяжелый металл, с плотностью равной 16,6 серебристо-серого цвета. Обладает хорошей пластичностью и высокими механическими свойствами, хорошо обрабатывается и сваривается. Из всех известных металлов обладает наиболее высокой коррозионной стойкостью, которая определяется свойством его защитных пленок. Тантал стоек в соляной и азотной кислотах при всех концентрациях и температурах, в фосфорной кислоте — при концентрациях до 35 % и температурах не выше 145 °С. Тантал нестоек только в плавиковой кислоте вследствие образования соединения TaFs, растворимого в HF, и в щелочах, в которых также образуются растворимые соединения — танталаты.
При нагревании в водородной атмосфере тантал поглощает водород до 740 объемов с образованием гидридов. Наводораживание также возможно при комнатной температуре при катодной поляризации тантала в электролитах. Поглощение металлом водорода приводит к сильному увеличению хрупкости тантала.
Тантал окисляется на воздухе при температурах выше 300 °С с образованием высшего оксида Та2Об. Он неустойчив в газообразном фторе даже при комнатной температуре, разрушается в среде брома при 300 °С, и йода при 1000 °С.
С Mo, W, Nb и Ti тантал образует непрерывный ряд твердых растворов. Сплавы тантала имеют повышенные прочностные характеристики. Как конструкционный материал тантал находит применение в химическом машиностроении. Из него изготавливают теплообменную аппаратуру для получения брома из смеси хлора и брома, для дистилляции соляной и азотной кислот из неочищенного сырья, при получении бромида этилена и хлористого бензола, при регенерации серной кислоты. Из тантала изготавливают нагреватели, работающие в особо агрессивных средах, например, в смеси хромовой и серной кислот, при дистилляции пероксида водорода. В ряде случаев тантал используют для плакировки аппаратуры из углеродистой стали.
| <== предыдущая страница | | | следующая страница ==> |
| Никель и его сплавы | | |
Дата добавления: 2015-07-26; просмотров: 587; Нарушение авторских прав

Мы поможем в написании ваших работ!