
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
История атомистических учений. Наблюдения и опыты, подтверждающие атомно-молекулярное строение вещества. Масса и размеры молекул
Молекулярная физика. Термодинамика
Раздел 2
Демокрит (ок. 460-370 до н..э.) утверждает, что все существующее состоит из атомов и пустоты. Атомы - это неделимые частицы. Атомы соединяются между собой и образуются вещи. Они различаются между собой формой, порядком и поворотом.
Древнегреческий философ Эпикур, признавая атомистику Демокрита, считал, что при движении атомы самопроизвольно отклоняются от прямолинейного движения и переходят в криволинейное.
Идеи Демокрита дошли до нас главным образом через сочинение римского поэта Тита Лукреция Кара (ок. 96 – 55 до н.э.) – обширную поэму «О природе вещей» (De rerum natura). Лукреций подробно излагает атомистическую теорию.
Лукреций связывает свойства вещей со свойствами составляющих их атомов: атомы жидкости малы и округлы, поэтому жидкость течет так легко и проникает сквозь пористое вещество, тогда как атомы твердых веществ имеют крючки, которыми они сцеплены между собой. Точно так же различные вкусовые ощущения и звуки различной громкости и тембра состоят из атомов соответствующих форм – от простых и гармоничных до извилистых и нерегулярных.
Аристотель В IV веке до н.э. появилось учение, которое позднее будет поддержано христианской церковью: «Любое тело может делиться до бесконечности»
Михаил Васильевич Ломоносов (1711-1765)
Развивал атомно-молекулярные представления о строении вещества. В период господства теории теплорода утверждал, что теплота обусловлена движением корпускул.
Предположил, что молекула может быть однородной и разнородной и находиться в хаотическом движении.
Даниил Бернулли (1700-1782)
В XVIII веке член Петербургской академии наук Д.Бернулли впервые применил понятие молекулы для объяснения давления газов.
Джеймс Клерк Максвелл (1831-1879)
Д.К. Максвелл первым высказал утверждение о статистическом характере законов природы.
В 1866 году им открыт первый статистический закон —
закон распределения молекул по скоростям.
Эрнест Резерфорд (1871-1937) предложил в 1911 году планетарную модель атома, осуществил в 1919 первую искусственную ядерную реакцию.
Атом - мельчайшая частица химического элемента, сохраняющая его свойства.
Молекула - наименьшая частица вещества, сохраняющая химические свойства этого вещества.
В основе молекулярно-кинетической теории лежат три основных положения:
1. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными, т.е. состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
2.Атомы и молекулы находятся в непрерывном хаотическом движении.
3. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Явление диффузии и броуновского движения подтверждают основные положения МКТ.
Явление, при котором происходит взаимное проникновение молекул одного вещества между молекулами другого, называется диффузией.
Диффузия может происходить в любых веществах: и в газах, и в жидкостях и в твердых телах. Наиболее быстро этот процесс произойдет в газах, потому что расстояние между молекулами достаточно большие, а силы притяжения между ними слабые. В жидкостях диффузия произойдет медленнее, чем в газах. Это объясняется тем, что молекулы расположены гуще, и поэтому «пробираться» через них труднее. Медленнее всего диффузия протекает в твердых телах, объяснимо это плотным расположением молекул. Если гладко отшлифованные пластины свинца и золота положить друг на друга и сжать грузом, то через пять лет можно наблюдать диффузию глубиной в один миллиметр.
Явление диффузии ускоряется с повышением температуры.
Броуновское движение - это тепловое движение мельчайших частиц, взвешенных в жидкости или газе. Оно было открыто английским ботаником Броуном (1827 г.) и явилось наглядным доказательством хаотичного молекулярного движения. Броуновские частицы движутся под влиянием ударов молекул. Из-за хаотичности теплового движения молекул, эти удары никогда не уравновешивают друг друга. В результате скорость броуновской частицы беспорядочно меняется по величине и направлению, а ее траектория представляет собой сложную зигзагообразную линию.
РАЗМЕРЫ И МАССЫ МОЛЕКУЛ
Атомная единица массы (а.е.м.) - 1,6.10-27кг - единица массы, равная 1/12 массы изотопа углерода с массовым числом 12.
 , где m0 - масса молекулы (атома);
m0С - масса атома углерода (изотоп 12С) , где m0 - масса молекулы (атома);
m0С - масса атома углерода (изотоп 12С)
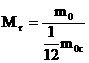 - относительная атомная масса
- определяется по таблице Менделеева!
Относительная молекулярная масса сложного вещества определяется как сумма относительных атомных масс всех атомов, входящих в состав данного вещества. - относительная атомная масса
- определяется по таблице Менделеева!
Относительная молекулярная масса сложного вещества определяется как сумма относительных атомных масс всех атомов, входящих в состав данного вещества.
|
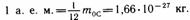
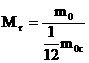 Пример:
Для H2 :
Пример:
Для H2 : 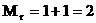 Для О2:
Для О2: 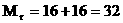 Для Н2О:
Для Н2О: 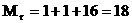 Для воздуха Mr=29
Для воздуха Mr=29
|
ν- количество вещества; [ν]=моль;
1 моль углерода имеет массу 0,012 кг
NA=6,02.1024 моль-1 - число (постоянная) Авогадро - количество структурных элементов (атомов, молекул) в 1 моле вещества (в 12 г углерода 12С).
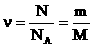 ,
где М - молярная масса (масса 1 моля); ,
где М - молярная масса (масса 1 моля);
 . .
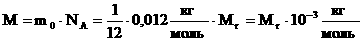
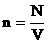 - концентрация - количество частиц в единице объема вещества. [n]=м-3 - концентрация - количество частиц в единице объема вещества. [n]=м-3
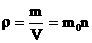 - плотность - масса единицы объема вещества.
[r]= кг/м3. - плотность - масса единицы объема вещества.
[r]= кг/м3.
| NA=6,02.1024 моль-1
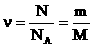
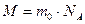
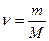
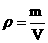
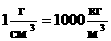
|
2. Оценим размеры молекулы, считая, что молекулы шарики.
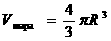 ,
следовательно, используя понятия плотности и молярной массы получим: ,
следовательно, используя понятия плотности и молярной массы получим: 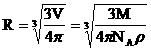 Например, для воды R»10-10м.
Например, для воды R»10-10м.
| |
2. Другой способ оценки размеров молекул. Известно, что некоторые несмешивающиеся с водой жидкости (масло, нефть, олеиновая кислота и др.), растекаясь по поверхности воды, могут образовывать очень тонкие пленки (толщиной до одного молекулярного ряда). Можно провести опыт, в котором, зная объем жидкости и измерив площадь, которую она заняла на поверхности воды, можно оценить размер молекулы. Например:
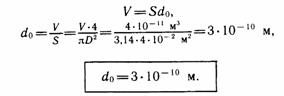
| 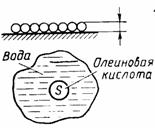 Олеиновая кислота - одноосновная насыщенная карбоновая кислота
Олеиновая кислота - одноосновная насыщенная карбоновая кислота 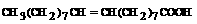
|
22. Тепловое движение. Абсолютная температура как мера средней кинетической энергии частиц. Объяснение агрегатных состояний вещества на основе атомно–молекулярных представлений.
В окружающем нас мире происходят различного рода физические явления, которые напрямую связанны с изменением температуры тел. Еще с детства мы знаем, что холодная вода при нагревании сначала становится едва теплой и лишь спустя определенное время горячей.
Такими словами как «холодный», «горячий», «теплый», мы определяем различную степень «нагретости» тел, или, если говорить языком физики на различную температуру тел. Температура теплой воды немного выше температуры прохладной воды. Если сравнивать температуру летнего и зимнего воздуха, то разница в температуре очевидна.
Температура тел измеряется с помощью термометра и выражается в градусах Цельсия (°C).
Как известно, диффузия при более высокой температуре происходит быстрее. Из этого следует, что скорость перемещения молекул и температура глубоко взаимосвязаны между собой. Если увеличить температуру, то скорость движения молекул увеличится, если уменьшить – понизится.
Таким образом, делаем вывод: температура тела напрямую зависит от скорости перемещения молекул.
Горячая вода состоит из абсолютно таких же молекул, как и холодная. Разница между ними состоит лишь в скорости передвижения молекул.
Явления, которые имеют отношение к нагреву или охлаждению тел, изменению температуры, получили название тепловые. К ним можно отнести нагревание или охлаждение воздуха, плавку метала, таяние снега.
Молекулы, либо атомы, которые являются основой всех тел, находятся в бесконечном хаотичном движении. Количество подобных молекул и атомов в окружающих нас телах огромно. В объеме равном 1 см³ воды, содержится приблизительно 3,34 · 10²² молекул. Любая молекула имеет очень сложную траекторию движения. К примеру, частицы газа, передвигающиеся с большими скоростями в различных направлениях, могут сталкиваться как друг c другом, так и со стенками сосуда. Таким образом, они меняют свою скорость и опять продолжают движение.
Рисунок №1 демонстрирует беспорядочное движение частиц краски, растворенных в воде.
Таким образом, делаем еще один вывод: хаотичное движение частиц, которые составляют тела, называют тепловым движением.
Хаотичность является важнейшей чертой теплового движения. Одним из самых главных доказательств движения молекул является диффузия и Броуновское движение.Броуновское движение – движение мельчайших твердых частиц в жидкости или газе под воздействием ударов молекул. Как показывает наблюдение. Броуновское движение не может прекратиться.
В жидкостях молекулы могут колебаться, вращаться и двигаться относительно других молекул. Если брать твердые тела, то в них молекулы и атомы колеблются около некоторых средних положениях.
В тепловом движении молекул и атомов участвуют абсолютно все молекулы тела, именно поэтому с изменением теплового движения меняется и состояние самого тела, его различные свойства. Таким образом, если повысить температуру льда то он начинает таять, принимая при этом уже абсолютно другую форму – лед становится жидкостью. Если же наоборот, понижать температуру, к примеру, ртути, то она изменит свои свойства и из жидкости, превратится в твердое тело.
Температура тела напрямую зависит от средней кинетической энергии молекул. Делаем очевидный вывод: чем выше температура тела, тем больше средняя кинетическая энергия его молекул. И, наоборот, при понижении температуры тела, средняя кинетическая энергия его молекул уменьшается.

Средняя кинетическая энергия поступательного движения молекул тела не зависит от его природы и пропорциональна абсолютной температуре газа T. Отсюда следует, что абсолютная температура является мерой средней кинетической энергии молекул.
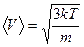 - средняя квадратичная скорость молекул.
- средняя квадратичная скорость молекул.
Газы легко сжимаются, обладают способностью неограниченно расширяться и занимать весь предоставленный им объем. Объясняется это тем, что в газах молекулы находятся на расстояниях, намного больших размеров молекул, поэтому силы взаимодействия между атомами и молекулами практически отсутствуют.
По своим свойствам жидкости занимают промежуточное положение между газами и твердыми телами. В жидкостях расстояние между молекулами меньше, чем в газах, силы взаимодействия между молекулами велики. Как показали исследования, молекулы жидкости некоторое время (время оседлой жизни) колеблются около положения равновесия, а по истечении этого времени перескакивают в новое положение равновесия и колеблются около него. Именно такое поведение молекул объясняет текучесть жидкостей, т. е. способность изменять свою форму под действием внешних сил. Жидкости принимают форму того сосуда, в который помещены. Характер расположения частиц жидкости промежуточный между газом и твердым телом. Для жидкостей характерен так называемый ближний порядок (в отличие от дальнего порядка в твердых телах), т. е. взаимное расположение соседних молекул в определенной степени упорядоченно, но на больших расстояниях (больше, чем межатомное) этот порядок нарушается. Жидкости малосжимаемы, так как при сжатии возрастают силы отталкивания, сохраняют свой объем и имеют свободную поверхность. Свойства жидкости одинаковы по всем направлениям, т. е. жидкость изотропна.
В твердых телах расстояние между молекулами меньше, чем в жидкостях, силы межмолекулярного взаимодействия значительны, поэтому твердые тела сохраняют не только свой объем, но и форму. Атомы и молекулы в твердых телах совершают хаотические колебания относительно положений равновесия, в которых силы притяжения уравновешивают силы отталкивания. Твердые тела обычно делят на две группы: кристаллические и аморфные. Аморфные тела, к которым относятся стекло, янтарь, воск, смола и др., являются переохлажденными жидкостями (жидкости с большой вязкостью). Их свойства (механические, тепловые, электрические, оптические) по всем направлениям одинаковы, т.е. аморфные тела изотропны. Для аморфных тел, как и для жидкостей, характерен ближний порядок в расположении частиц, но, в отличие от жидкостей, подвижность частиц мала. Характерной особенностью аморфных тел является отсутствие у них определенной точки плавления, т.е. нельзя указать температуру, выше которой будет жидкое состояние, а ниже – твердое. Со временем в аморфных телах происходит кристаллизация, поэтому стекло с течением времени теряет прозрачность, мутнеет. В последнее время очень широкое практическое применение получили органические аморфные тела – полимеры. Молекулы полимеров состоят из большого числа одинаковых длинных молекулярных цепочек, соединенных химическими связями. К полимерам относятся крахмал, белок, каучук, пластмасса, резина, капрон и др. вещества. Полимеры обладают прочностью и эластичностью, некоторые из них могут выдерживать растяжение, превышающее их первоначальную длину в 5–10 раз. Кристаллические твердые тела имеют правильную геометрическую форму, которая является результатом их упорядоченной структуры. Атомы и молекулы в кристаллах располагаются с периодической повторяемостью в трех измерениях по всему кристаллу (дальний порядок). Такие структуры, характеризующиеся регулярным расположением частиц с периодической повторяемостью, называются кристаллической решеткой. Различают монокристаллы и поликристаллы. Монокристаллы – твердые тела, имеющие единую кристаллическую решетку по всему объему. Это крупные одиночные кристаллы, каковыми являются, например, большинство минералов. Такие кристаллы встречаются в природе редко, в основном монокристаллы выращивают искусственно. Большинство твердых тел состоят из множества беспорядочно ориентированных мелких кристалликов. Такие твердые тела называются поликристаллами. Монокристаллы обладают анизотропией, т. е. имеют неодинаковые физические свойства по разным направлениям, поликристаллические тела изотропны. Анизотропия монокристаллов объясняется тем, что расстояния между атомами в кристаллической решетке и силы взаимодействия по разным направлениям различны.
Дата добавления: 2014-02-26; просмотров: 2780; Нарушение авторских прав

Мы поможем в написании ваших работ!