
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ПРАВИЛА ЗАМЕЩЕНИЯ В АРОМАТИЧЕСКОМ ЯДРЕ
Правила замещения атомов водорода в ядре касаются только гомологов бензола, т.к. в самом бензоле распределение электронной плотности равномерное, и реагенту безразлично, какой протон замещать. При введении заместителя распределение электронной плотности изменяется, поэтому реакции электрофильного замещения будут подчиняться следующим правилам.
Все заместители делятся на два рода. К первому роду относятся заместители, имеющие частичный или полный отрицательный заряд или неподеленную пару электронов на ключевом атоме. Они подают электронную плотность в ядро, сообщая ему частичный отрицательный заряд преимущественно в орто- и пара-положения, облегчают реакции с электрофильными реагентами и направляют их именно в о- и п-положения по отношению к себе.

где Е+ – электрофильная частица; А – заместитель I-рода.
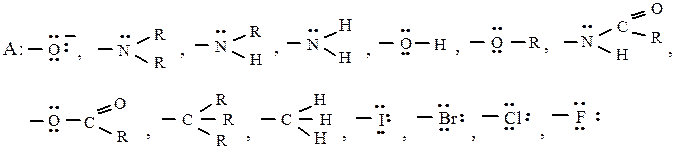
|
К заместителям второго рода относятся электроноакцепторные, имеющие на ключевом атоме частичный или полный положительный заряд и забирающие электронную плотность из ядра, преимущественно из орто- и пара-положений. Поэтому они затрудняют реакции электрофильного замещения и направляют их в мета-положение по отношению к себе.
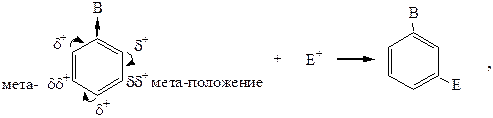
где В – заместитель II-рода.
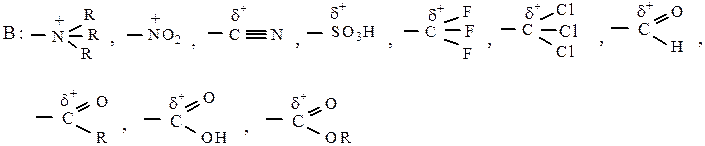
|
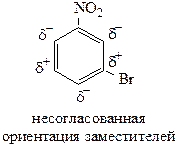 В том случае, если в ядре имеется 2 заместителя, может наблюдаться либо согласованная, либо несогласованная ориентация этих заместителей. Согласованная ориентация – когда оба заместителя направляют реакции электрофильного замещения в одно и тоже положение бензольного ядра, несогласованная ориентация – когда заместители направляют электрофильную частицу в разные положения ядра. В случае несогласованной ориентации направлять электрофильные реагенты будет тот заместитель, который облегчает реакцию с ними. Для определения вида ориентации необходимо рассмотреть влияние каждого заместителя отдельно и установить, в какие положения направляются реакции электрофильного замещения. Например:
В том случае, если в ядре имеется 2 заместителя, может наблюдаться либо согласованная, либо несогласованная ориентация этих заместителей. Согласованная ориентация – когда оба заместителя направляют реакции электрофильного замещения в одно и тоже положение бензольного ядра, несогласованная ориентация – когда заместители направляют электрофильную частицу в разные положения ядра. В случае несогласованной ориентации направлять электрофильные реагенты будет тот заместитель, который облегчает реакцию с ними. Для определения вида ориентации необходимо рассмотреть влияние каждого заместителя отдельно и установить, в какие положения направляются реакции электрофильного замещения. Например:
–Br – заместитель I рода, направляет реакции в о- и п-положения (δ-);
–NO2 – заместитель II рода, направляет электрофильную частицу в м-положение (δ+). Направление заместителей не совпало, следовательно ориентация несогласованная. Направлять реакции будет –Br, т.к. он облегчает реакции электрофильного замещения
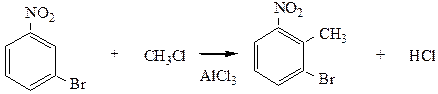
В случае согласованной ориентации реагент направляется только в одно положение бензольного ядра:
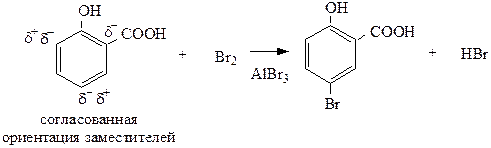
2) Реакции присоединения. Затруднены для бензола и его гомологов, которые могут присоединять по двойным связям, имеющимся в ядре либо водород при повышенной температуре, давлении и наличии специальных катализаторов; либо хлор или бром при интенсивном ультрафиолетовом облучении.
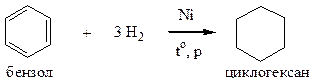
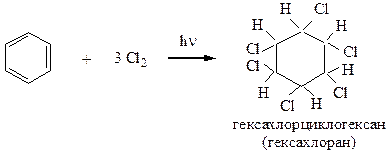
3) Реакции окисления. Для бензола реакции окисления обычными сильными окислителями не протекают, ядро бензола можно окислить только в очень жестких условиях, например, кислородом воздуха в присутствии V2O5 при нагревании до 450 оС:
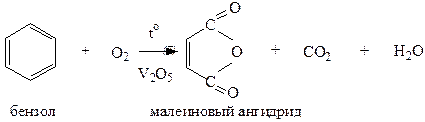
Арены могут быть также окислены озоном по двойным связям, имеющимся в ядре. Конечные продукты озонолиза имеют также строение, как будто окислению подвергается смесь двух структур Кекуле:
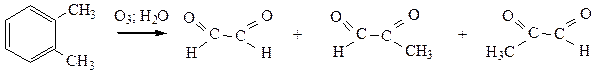
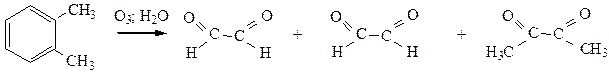
Гомологи бензола, содержащие в боковой цепочке алкильные группировки, могут быть окислены обычными сильными окислителями (KMnO4 при нагревании, K2Cr2O7 + H2SO4, концентрированными кислотами при нагревании). Окислению до карбоксильной группы подвергается углерод, находящийся в α-положении по отношению к ядру, какой бы длины не была боковая цепочка.
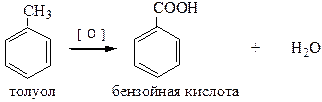
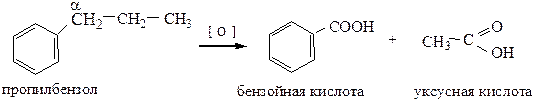
Если цепочек несколько, то окислению подвергаются все с образованием бензолдикарбоновых кислот, бензолтрикарбоновых кислот и.т.д.
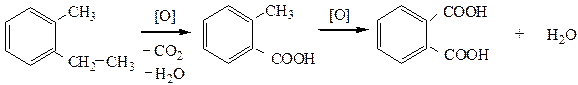
При применении специальных условий окисления из гомологов бензола можно получить ароматические альдегиды или кетоны:
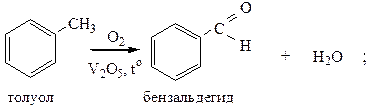
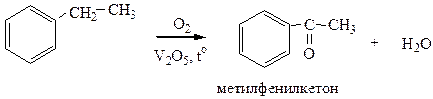
ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ
К функциональным производным относятся органические соединения, в углеводородной цепочке которых один или несколько атомов водорода замещены на функциональные группы.
По виду и количеству функциональных групп бывают монофункциональные (одна группа), гомополифункциональные (несколько одинаковых групп) и соединения со смешанными функциями (когда группы разные).
| <== предыдущая страница | | | следующая страница ==> |
| Понятие об ароматичности | | | ГАЛОГЕНОПРОИЗВОДНЫЕ |
Дата добавления: 2014-04-15; просмотров: 1029; Нарушение авторских прав

Мы поможем в написании ваших работ!