
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ПЕПТИДЫ
|
Читайте также: |
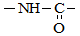 Пептиды – это амиды, образующиеся при взаимодействии карбоксильной группы одной аминокислоты и аминогруппы второй аминокислоты. Амидная связь называется пептидной связью, именно таким типом связаны остатки аминокислот в белковых молекулах.
Пептиды – это амиды, образующиеся при взаимодействии карбоксильной группы одной аминокислоты и аминогруппы второй аминокислоты. Амидная связь называется пептидной связью, именно таким типом связаны остатки аминокислот в белковых молекулах.
В зависимости от числа аминокислотных остатков различают ди-, три-, тетра- и т.д. полипептиды (с молекулярной массой до 10000; свыше 10000 – белки).
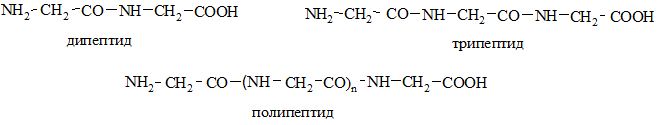
Последовательность соединения остатков аминокислот в молекуле пептида влияет на его свойства. При взаимодействии двух аминокислот (А и В) могут быть образованы 4 дипептида: АА, ВВ, АВ, ВА. Например, из глицина и аланина:

образуются дипептиды:
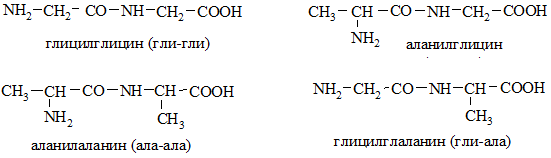
При составлении названия дипептида вначале называется остаток аминокислоты, прореагировавший своей карбоксильной группой, а затем – остаток аминокислоты, участвующей в реакции аминогруппой.
Полипептиды встречаются в организмах человека и животных, являясь прежде всего, продуктами распада белков. Ряд пептидов играет важную биологическую роль (например, декапептид – грамицидин С – антибиотик; гормоны – окситоцин, инсулин, вазопрессин и т.д.).
Белки
Белки – высокомолекулярные вещества, молекулы которых состоят из остатков двух аминокислот, соединенных друг с другом по типу амидной связи.
Классификация.
Белки подразделяются на протеины (простые белки), состоящие только из остатков аминокислот и протеиды (сложные белки), которые при гидролизе дают аминокислоты и вещества небелковой природы (H3PO4, углеводы, липиды, нуклеиновые кислоты, гетероциклические соединения).
Протеины разделяются на:
а) альбумины – белки с небольшой молекулярной массой, хорошо растворимые в воде, при нагревании денатурируются (сворачиваются). Пример – яичный белок.
б) глобулины – белки, нерастворимые в воде, но растворимые в теплом 10 %-ном растворе NaCl. Входят в состав мышечных тканей, крови, молока, семян, яиц.
в) проламины – плохо растворимы в воде, хорошо – в 60-80 %-ном этаноле. Характерны для семян злаков.
г) глютелины – растворимы в 2 %-ной щелочи. Найдены в семенах пшеницы, риса, кукурузы.
д) протеиноиды – нерастворимые белки. Входят в состав волос, ногтей, рогов, копыт и сухожилий.
е) фосфопротеины – белки, содержащие H3PO4. Играют большую роль в питании молодого организма (белок молока – казеин).
Протеиды делятся на:
а) липопротеиды – состоят из простого белка и липидов (жиров). Входят в состав протоплазмы клеток, а также в зернах хлорофилла.
б) гликопротеиды – состоят из простого белка и высокомолекулярных углеводов. Содержатся в слизистых тканях.
в) хромопротеиды – простые белки и красящие вещества. Например, гемоглобин крови гидролизуется на белок глобин и сложное азотистое основание, содержащее Fe.
г) нуклеопротеиды – простые белки и нуклеиновые кислоты.
Строение белков
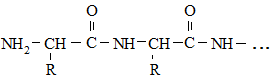 Кроме пептидных связей
Кроме пептидных связей
в белках отдельные цепи или участки могут быть соединены между собой дисульфидными (–S–S–), солевыми и водородными связями:
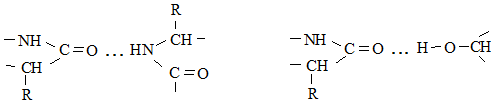
Солевые связи образуются при взаимодействии свободных аминогрупп и кислотных групп.
Различают первичную, вторичную, третичную и четвертичную структуры белка.
Первичная структура – вид, число и последовательность соединения аминокислотных остатков в полипептидной цепи.
Вторичная структура – зигзагообразная или спиралевидная конфигурация белковых молекул, которая поддерживается за счет водородных связей.
Третичная структура – пространственное расположение спиралевидной полипептидной цепи (она может располагаться по-разному). Любые изменения в третичной структуре влияют на свойства белков.
Четвертичная структура – объединение нескольких частиц с третичной структурой за счет водородных, солевых, ионных связей.
Свойства белков
Белки экстрагируют из белоксодержащего сырья водой, растворами солей, щелочей, кислот, спиртовыми растворами. Затем его очищают – обрабатывают солями (высаливают), спиртом или щелочами, нейтрализуют. Выделенные и очищенные белки чаще всего имеют вид белого порошка фибриллярного (нитевидного) или глобулярного (шаровидного) типа.
Многие белки растворимы в воде, щелочах, кислотах, но не растворимы в органических растворителях. В растворах белки представляют собой высокомолекулярные коллоиды. Белки относятся к амфотерным веществам (т.к. содержат карбоксильные и аминогруппы), в кислых растворах проявляют основные свойства, в щелочах – кислотные. Поэтому для белков существует изоэлектрическая точка – одна из основных констант белка.
При действии высокой температуры, концентрированных кислот и щелочей белки денатурируют (сворачиваются), т.е. происходит нарушение вторичной, третичной и четвертичной структуры.
Белки гидролизуются растворами кислот, щелочей и некоторых ферментов с образованием в конечном итоге α-аминокислот:

Цветные реакции белков
Это реакции, связанные с наличием в белках аминокислотных остатков и определенных группировок.
Биуретовая – проявление фиолетового окрашивания при обработке концентрированным раствором щелочи и насыщенным раствором CuSO4 – качественная реакция на пептидные связи.
Ксантопротеиновая – проявление желтой окраски под действием HNO3 конц., реакция на ароматические кольца.
Миллоновая – проявление вишнево-красной окраски при обработке раствором Миллона (раствор нитрата ртути в азотистой кислоте), реакция на фенольные группировки.
Сульфгидрильная – выпадение черного осадка сульфида свинца при нагревании с раствором плюмбита, реакция на S.
Реакция Адамкевича – фиолетовое окрашивание при добавлении глиоксалевой и концентрированной серной кислот, реакция на индольные группы.
Функции белков. Их использование.
Белки в организме человека выполняют разнообразные функции: каталитические, строительные (из них состоит основная масса протоплазмы клеток), энергетические, обменные, защитные и др. Белками являются многие физиологически активные соединения: ферменты, некоторые гормоны и антибиотики, а также другие вещества.
Белки являются необходимой составной частью пищевого рациона. Главным источником белков являются: мясо (20 % белка), рыба (до 18 %), яйца (до 25 %), молоко (до 3 %), сыр (до 22,5 %), пшеничный хлеб (до 8 %), изделия из круп (до 10 %), бобовые и масличные культуры (20-35 %). Овощи относительно бедны белком (до 2 %), но способствуют лучшей усвояемости белков.
Суточная потребность в белке взрослого человека – 100-150 г. Основное качество пищевого белка – способность снабжать организм необходимым количеством аминокислот.
В последнее время пищевые производства в качестве приоритетных включают технологии получения белковых продуктов (разнообразных модифицированных и специальных белковых продуктов, использующихся как функциональные или пищевые добавки к пище). В основном их производят из сои или пшеницы с добавлением лимитирующих аминокислот.
| <== предыдущая страница | | | следующая страница ==> |
| Значение аминокислот | | | ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ |
Дата добавления: 2014-04-15; просмотров: 597; Нарушение авторских прав

Мы поможем в написании ваших работ!