
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
К гетероциклическим относятся органические соединения, содержащие в своих молекулах циклы, в которых кроме углерода есть атомы других элементов (гетероатомы: O, N, S).
Гетероциклические соединения классифицируются:
а) по числу атомов в цикле (от трехчленного до макроциклического);
б) по количеству и виду гетероатомов (–O, –N, –S);
в) по степени ненасыщенности гетероцикла (насыщенные и ненасыщенные).
Особый интерес представляют ненасыщенные гетероциклические соединения, которые удовлетворяют условиям ароматичности: по количеству π-электронов соответствуют правилу Хюккеля; имеют плоское строение и замкнутую систему π-электронов.
При наименовании гетероциклов широко используются тривиальные названия:
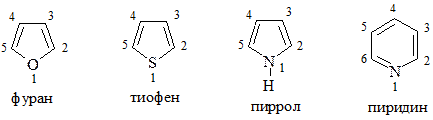
Нумерация в гетероциклах фиксирована и в большинстве случаев зависит от старшинства заместителей. В отдельную группу выделяют гетероциклические соединения с конденсированными ядрами:

Гетероциклические соединения играют большую роль в жизнедеятельности организмов и имеют важное физиологическое значение (ДНК, РНК, хлорофилл, алкалоиды, ряд витаминов, антибиотиков).
ПЯТИЧЛЕННЫЕ СИСТЕМЫ С ОДНИМ ГЕТЕРОАТОМОМ
Наиболее важными представителями являются фуран, тиофен, пиррол. Все они являются ароматическими соединениями: удовлетворяют правилу Хюккеля, 4 электрона атома углерода цикла находятся в π-сопряжении с неподеленной парой электронов гетероатома, сам цикл имеет плоское строение. Поэтому как для бензола, их формулы могут быть изображены следующим образом:
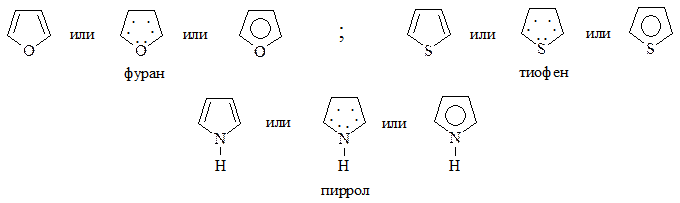
СПОСОБЫ ПОЛУЧЕНИЯ
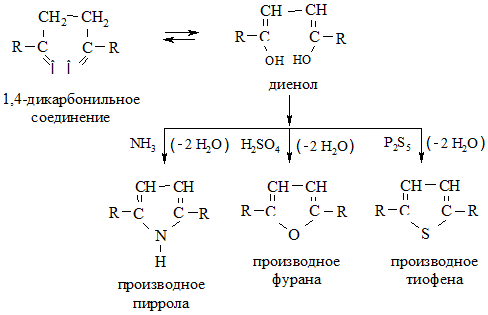
1. Циклизация 1,4-дикарбонильных соединений (дикетонов, дикарбоновых кислот или кетокислот). При их нагревании с дегидратирующим агентом (CaCl2, H2SO4, P2O5) образуются производные фурана; при проведении дегидратации в среде NH3 – пиррола; в присутствии P2S5 – тиофена:
2. Выделение из природных источников. Тиофен и пиррол содержатся в каменноугольной смоле, фуран – из пентозансодержащего сырья (шелуха семян подсолнечника, кукурузные кочерыжки) через стадию получения фурфурола.
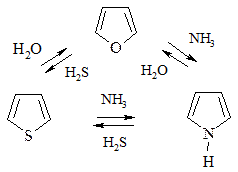
3. Взаимопревращения фурана, тиофена, пиррола (реакция Юрьева) происходят при t=450 oC над Al2O3:
4. Взаимодействие ацетилена с сероводородом или аммиаком. При пропускании смеси H2S над Al2O3 образуется тиофен
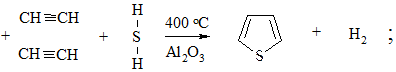
а смеси с NH3 – пиррол
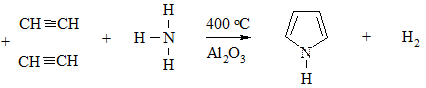
Физические свойства
Все три вещества – бесцветные жидкости, практически нерастворимые в воде.
ХИМИЧЕСКИЕ СВОЙСТВА
Так как данные соединения обладают ароматическим характером, для них характерны реакции электрофильного замещения (нитрование, сульфирование, галогенирование, ацилирование), протекающие в положение 2 (α-положение) в очень мягких условиях.
Фуран, тиофен и пиррол являются слабыми основаниями. Продукты протонирования фурана и пиррола минеральными кислотами:
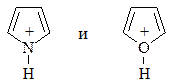
неустойчивы, получающийся катион быстро теряет ароматичность, приобретает свойства сопряженного диена и легко полимеризуется. Это явление называется ацидофобностью (“боязнь кислоты”).
Тиофен не ацидофобен (из-за равенства электроотрицательностей атомов S и С цикла). Пиррол способен проявлять кислотные свойства по связи N–H и замещать атом водорода на атом Na или К при взаимодействии с металлами или концентрированной щелочью КОН:
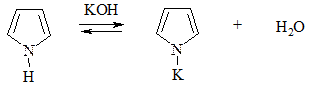
1. Галогенирование. Проводится комплексом Br2 с диоксаном, Br2 при низкой температуре (бромирование) или Cl2 при пониженной температуре, SO2Cl2 (хлорирование):
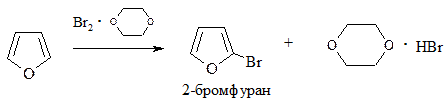
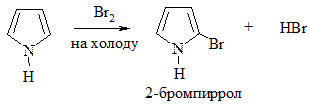
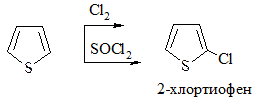
2. Сульфирование. Проводится пиридинсульфотриоксидом C5H5N·SO3, так как в этом случае в реакционной смеси отсутствуют соединения кислотного характера:
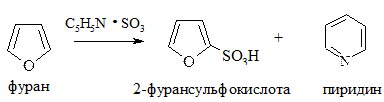
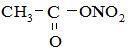 3. Нитрование. Проводится ацетилнитратом (смесь уксусного ангидрида и HNO3):
3. Нитрование. Проводится ацетилнитратом (смесь уксусного ангидрида и HNO3):
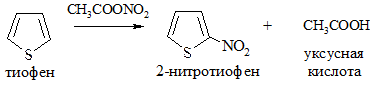
4. Ацилирование. Осуществляется ангидридами кислот в присутствии катализаторов: AlCl3, SnCl4, BF3 (реакция Фриделя-Крафтса):
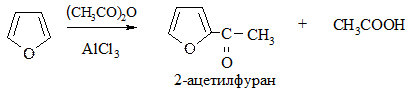
5. Алкилирование по Фриделю-Крафтсу провести не удается, однако пирролкалий при взаимодействии с галогенопроизводными дает N-алкилпирролы, изомеризующиеся при нагревании в 2-алкилпирролы:
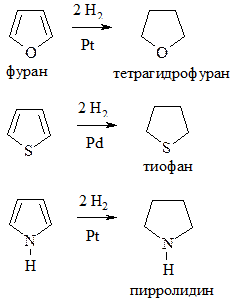
6. Гидрирование. Происходит в присутствии катализаторов Ni или Pt – для фурана и пиррола, Pd – для тиофена:
ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ С ОДНИМ АТОМОМ АЗОТА
Наибольший интерес представляет собой пиридин:
Является гетероциклическим аналогом бензола, у которого одна группа –СН= заменена на sp2-гибридный атом углерода. Обладает ароматическим характером. Так как неподеленная пара электронов атома азота не вступает в π-сопряжение, пиридин не ацидофобен и проявляет высокие основные свойства. Электронная плотность в кольце снижена, особенно в положениях 2,4,6, поэтому пиридин легче вступает в реакции нуклеофильного, чем электрофильного замещения.
СПОСОБЫ ПОЛУЧЕНИЯ
1. Выделение из природных источников. Пиридин и его гомологи получают из каменноугольного дегтя.
2. Гомологи пиридина могут быть получены следующими способами:
2.1. Конденсация альдегидов с аммиаком
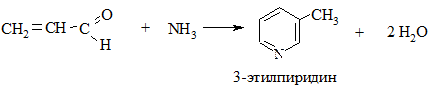
2.2. Взаимодействие ацетилена с аммиаком (метод Репе)
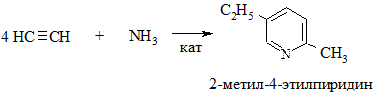
2.3. Конденсация β-дикетонов или β-кетоэфиров с альдегидами и аммиаком (метод Ганча). Промежуточно образующиеся при этом 1,4-дигидропиридины окисляют до пиридинов азотной кислотой или NO2
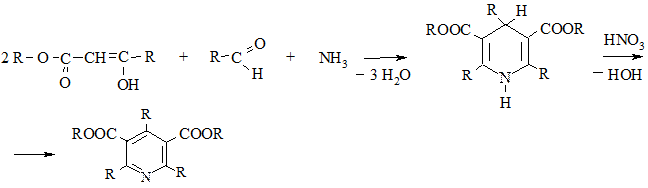
Дальнейший гидролиз и декарбоксилирование полученного продукта приводит к триалкилпиридинам.
Физические свойства
Пиридин – бесцветная жидкость с характерным неприятным запахом. Растворим в воде, образует с ней смесь с плотностью ρ=1,00347 г/дм3.
ХИМИЧЕСКИЕ СВОЙСТВА
1. Основность. Пиридин проявляет основные свойства в большей степени, чем фуран, тиофен и пиррол. Являясь слабым основанием, с сильными минеральными кислотами дает соли пиридиния, имеющие ароматический характер

2. Алкилирование. Проводится галогенопроизводными с образованием солей пиридиния, которые при нагревании дают 2- (или 4-) алкилзамещенные пиридины
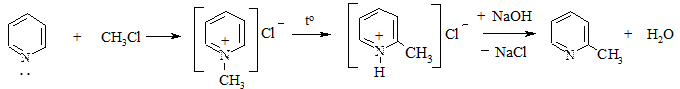
3. Реакции электрофильного замещения. Для пиридина протекают с трудом (так как атом азота обладает акцепторными свойствами) в положение 3
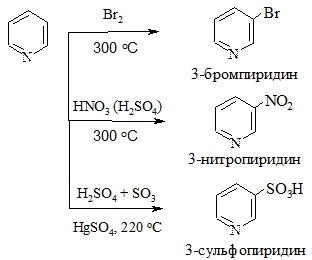
4. Реакции нуклеофильного замещения. Протекают легко (из-за обеднения кольца электронной плотностью) в положение 2

5. Восстановление. Проводится водородом в жестких условиях
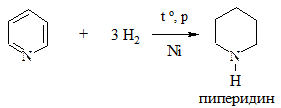
6. Окисление пиридина происходит только в очень жестких условиях. Гомологи, содержащие алкильные боковые цепочки, окисляются по ним аналогично гомологам бензола
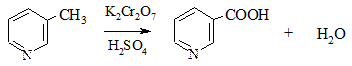
| <== предыдущая страница | | | следующая страница ==> |
| ПЕПТИДЫ | | | ЛЕКЦИЯ 5 ТИПЫ ПРИСЛОВНОЙ СВЯЗИ |
Дата добавления: 2014-04-15; просмотров: 1531; Нарушение авторских прав

Мы поможем в написании ваших работ!