
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
АМИНОКИСЛОТЫ, ПОЛИПЕПТИДЫ
|
Читайте также: |
10.1 Аминокислоты
Аминокислотами называют соединения, в которых одновременно содержатся аминная и карбоксильная группы. Простейшие аминокислоты имеют тривиальные названия. Обычно же их называют как замещённые соответствующих кислот, обозначая положение аминогрупп относительно кислотной буквами α, β, γ, δ и т. д. Используется также названия по номенклатуре ИЮПАК:
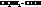
| глицин, гликокол, аминоуксусная, аминоэтановая |

| α-аланин, α-аминопропионовая, 2-аминопропановая |

| β-аланин, β-аминопропионовая, 3-аминопропановая |

| валин, α-аминовалериановая, 2-аминопентановая |
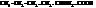
| α-аминокапроновая 2-аминогексановая |
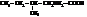
| изолейцин, 2-амино-3-метилпентановая |

| лизин, α,δ-диаминокапроновая, 2,6-диаминогексановая |
Аминокислоты могут содержать одну или несколько кислотных групп и различаться по основности. В молекулу аминокислоты может также входить и несколько аминогрупп.
Методы получения
– Аминокислоты имеют чрезвычайно большое физиологическое значение. Из остатков аминокислот построены белки и полипептиды. При гидролизе белковых веществ животных и растительных организмов образуются аминокислоты.
– Действие аммиака на галоидзамещённые кислоты

– α-Аминокислоты получают действием аммиака на оксинит-рилы
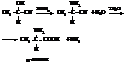
Оксинитрилы получают действием на альдегиды HCN

Физические свойства
Аминокислоты в настоящее время рассматриваются как продукты нейтрализации карбоксила и аминогруппы в одной и той же молекуле, т.е. как внутренние соли
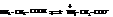
Молекула внутренней соли является биполярным ионом, то есть молекулой с разноимёнными зарядами на противоположных концах молекулы.
Существованием аминокислот в виде биполярных ионов объясняются высокие температуры плавления аминокислот, их малая летучесть, нерастворимость в углеводородах и хорошая растворимость в воде. Некоторые аминокислоты оптически активны.
Химические свойства
Поскольку в молекулах аминокислот имеются амино- и карбоксильные группы, они вступают в реакции, характерные для этих функциональных групп. Эти реакции были рассмотрены ранее в соответствующих разделах курса.
Дополнительно к этому познакомимся со свойствами аминокислот, которые обусловлены одновременным присутствием в структуре молекул обеих функциональных групп.
– Наличие в молекуле аминокислоты кислотной и основной групп обуславливает амфотерность этих соединений и существование их в виде биполярного иона. В кислой среде образуется катион соли аминокислоты как основания, в щелочной – анион соли аминокислоты, как кислоты.
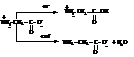
Концентрация водородных ионов (рН среды), при которой амфотерное соединение наименее и в равной мере диссоциировано по обоим направлениям, называется изоэлектрической точкой.
В изоэлектрической точке аминокислота существует в виде биполярного иона (в целом электрически нейтрального соединения), поэтому в изоэлектрической точке водные растворы аминокислот неэлектропроводны. Изоэлектрическая точка для каждой аминокислоты является индивидуальной характеристикой и может использоваться для их идентификации.
– С основаниями аминокислоты образуют соли. Особенно характерно образование медных солей, имеющих интенсивную синюю окраску. Эти вещества являются внутрикомплексными соединениями
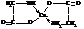
– Химическое поведение аминокислот в значительной мере определяется взаимным расположением аминогруппы и карбоксила. Особенно ярко это проявляется при нагревании аминокислот.
α-Аминокислоты при нагревании легко отщепляют воду и дают дикетопиперазины.
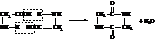
β-Аминокислоты отщепляют аммиак и образуют аммонийную соль непредельной кислоты

γ- и δ-Аминокислоты отщепляют воду внутримолекулярно и дают лактамы
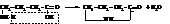
Отдельные представители
α-Аминопропионовая кислота (α-аланин)
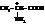
В α-аланине имеется асимметрический атом углерода. Поэтому он оптически активен. L(+)-аланин входит в состав всех белков. Его можно получать гидролизом фиброина шёлка.
2,6-диаминогексановая кислота (лизин)
*

В состав лизина входят две аминогруппы и один карбоксил. Поэтому он является сильным основанием. L(+)-лизин входит в состав белков и относится к незаменимым аминокислотам.
6-Аминогексановая кислота (ε-аминокапроновая)
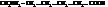
Эта кислота и её лактам, капролактам, используется для получения синтетического волокна капрон.
10.2 Полипептиды
Известно, что аминокислоты входят в состав белков. Белки находятся во всех растительных и животных организмах и являются главными носителями жизни (Ф.Энгельс: «Жизнь есть способ существования белковых тел…»).
Несмотря на многочисленность белков, в их состав входят не более 22 разных аминокислот. При гидролизе белок превращается в смесь аминокислот.
Изучение состава, строения и свойств белков составляет предмет последующего курса «Биологическая химия». В рамках курса «Органическая химия» рассмотрим вопросы об основных формах связи аминокислот в сложной молекуле белка и основные принципы химического синтеза полипептидов. Гидролиз природных белков показал, что в их состав входят α-аминокислоты. Ещё в 1891 г.
А.Я. Данилевский высказал предположение, что α-аминокислоты связываются в белке за счёт амидных связей, образованных карбоксилом одной молекулы аминокислоты и аминогруппой другой.

Такого рода связи носят название «пептидных связей». Этим путём могут быть соединены 2,3,4… остатка одинаковых или разных
α-аминокислот в виде дипептида, трипептида, тетрапептида и т. д. Такие соединения в общем случае называются полипептидами.
Молекулы полипептидов (белков) в общем случае будут иметь следующую структуру:
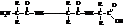
Полипептиды различаются между собой длиной основной цепи, составом и строением радикалов R и последовательностью их чередования в структуре молекулы, иными словами, последовательностью чередования остатков аминокислот. По концам молекулы полипептида расположены карбоксильная и аминогруппы.
Белки построены сложнее полипептидов. Белками называют полипептиды большой молекулярной массы, способные к организации устойчивой пространственной структуры, которой нет у полипептидов. Однако отдельные фрагменты белковой молекулы могут рассматриваться как полипептидные звенья.
Пептиды имеют чрезвычайно важное значение. Пептидные гормоны и нейропептиды, например, регулируют большинство процессов организма человека, в том числе, принимают участие в процессах регенерации клеток. Пептиды иммунологического действия защищают организм от попавших в него токсинов. Для правильной работы клеток и тканей необходимо адекватное количество пептидов. Однако с возрастом и при болезнях возникает дефицит пептидов, который существенно ускоряет износ тканей, приводит к старению всего организма. Сегодня проблему недостаточности пептидов в организме научились решать. Пептидный набор клетки восполняют синтезированными в лабораторных условиях пептидами.
Поскольку природные полипептиды состоят из остатков различных α-аминокислот, при их получении синтетическим путём возникают большие трудности. Во-первых, необходимо выдержать определённую последовательность соединения аминокислот, и во-вторых – избежать соединения двух молекул одной кислоты, остаток которой вводится в пептид при наращивании его цепи.
Первое обстоятельство выполняется при стадийном проведении синтеза. На каждой стадии к полипептиду, полученному на предыдущей стадии, добавляется один аминокислотный остаток и продукт очищается. Однако, из-за большого числа таких стадий и трудоемкости очистки синтез занимает много времени и общий выход конечного продукта чрезвычайно мал. Действительно, первый полный синтез пептида, гормона окситоцина (1953 г.), содержащего всего 8 амино-кислотных остатков, рассматривался как выдающееся достижение, принесшее его автору, В. дю Виньо, Нобелевскую премию 1955 года.
Следует отметить, что две различные аминокислоты могут образовывать четыре дипептида. Так, в смеси глицина и аланина образуются следующие дипептиды:
 Количество дипептидов резко возрастает с увеличением числа участвующих в их образовании неодинаковых аминокислот.
Количество дипептидов резко возрастает с увеличением числа участвующих в их образовании неодинаковых аминокислот.
Для того, чтобы избежать произвольного соединения остатков аминокислот, в том числе и одинаковых, применяют специальные приемы пептидного синтеза: защиту (блокирование) одних функциональных групп и активацию других.
Так, чтобы в смеси глицина и аланила однозначно получался только первый дипептид (глицилаланин), необходимо заблокировать аминогруппу глицина и карбоксильную группу аланина. Образование остальных трех дипептидов становится невозможным. Желательно при этом активировать кислотную группу глицина, переведя ее, например, в хлорангидридную, и аминогруппу аланина.
При синтезе полипептидов, содержащих большое число аминокислотных остатков, требуется проведение множества реакций, которые сопровождаются однотипными операциями по выделению и очистке продукта на каждой стадии, что сопряжено с большими затратами времени. Для решения этих проблем был предложен твердофазный синтез пептидов на полимерной матрице (Меррифилд, 1962 г., Нобелевская премия). В настоящее время созданы автоматические приборы (синтезаторы), которые в запрограммированной последовательности осуществляют все необходимые операции. Эти методики используются, например, для получения гормона инсулина, необходимого больным диабетом для снижения содержания сахара в крови.
| <== предыдущая страница | | | следующая страница ==> |
| ГИДРОКСИКИСЛОТЫ | | | АЛЬДЕГИДО- И КЕТОКИСЛОТЫ |
Дата добавления: 2014-10-02; просмотров: 824; Нарушение авторских прав

Мы поможем в написании ваших работ!