
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ГИДРОКСИКИСЛОТЫ
Гидроксикислоты относятся к соединениям со смешанными функциями. Так называют органические соединения, содержащие две или более различных функциональных групп. К этой обширной группе соединений относятся также аминокислоты, альдегидо- и кетокислоты, гидроксиальдегиды, гидроксикетоны, углеводы и многие другие.
9.1 Алифатические гидроксикислоты
Гидроксикислоты – это органические вещества, в состав которых входят гидроксильная и карбоксильная группы.
Например, СН2–СООН – гидроксиуксусная кислота.
׀
ОН
Для гидроксикислот различают понятия основности и атомности. Основность гидроксикислот измеряется числом карбоксильных групп в молекулах, а атомность – числом гидроксилов, включая и гидроксилы кислотных групп. Так, молочная кислота является одноосновной и двухатомной

яблочная – двухосновной и трёхатомной

Изомерия. Номенклатура
Простейшие гидроксикислоты обычно имеют тривиальные названия по природным источникам их получения: молочная, яблочная, винная и т.д.
Гидрксикислоты могут быть названы как гидроксипроизводные карбоновых кислот. Положение гидроксила относительно карбоксила указывается греческими буквами α, β, γ и т.д.
Названия гидроксикислот по номенклатуре ИЮПАК происходят от названий соответствующих карбоновых кислот с добавлением приставки гидрокси-, указывающей на гидроксил. Нумерация начинается с карбоксильной группы.
Изомерия гидроксикислот определяется изомерией углеродного скелета, числом и взаимным расположением групп –ОН и –СООН.

| угольная, гидроксимуравьиная, гидроксиметановая |
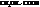
| гликолевая, гидроксиуксусная, гидроксиэтановая |

| молочная, α-гидроксипропионовая, 2-гидроксипропановая |

| гидракриловая, β-гидроксипропио-новая, 3-гидроксипропановая |

| α-гидроксимасляная, 2-гидроксибутановая |
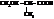
| β-гидроксиизомасляная, 2-метил-3-гидроксипропановая |

| яблочная, гидроксиянтарная, |

| винные, дигидроксиянтарная |
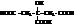
| лимонная, 3-гидрокси-3-карбоксипентандиовая |

| изолимонная, 2-гидрокси-3-карбоксипентандиовая |
Способы получения
Способы получения рассмотрим на примере одноосновных двухатомных гидроксикислот.
– Гидролиз галогензамещённых кислот
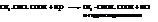
– α-Гидроксикислоты получают гидролизом оксинитрилов
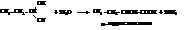
– β-Гидроксикислоты чаще всего получают по реакции Реформатского. Реакция заключается в действии цинка на смесь эфира галогензамещённой кислоты и альдегида или кетона с промежуточным образованием алкоголята эфира β-гидроксикислоты:

Гидрксикислоты могут быть получены также окислением гидроксиальдегидов и гликолей, присоединением воды к ненасыщеным кислотам и другими методами.
Физические свойства
Низшие гидроксикислоты – жидкие вещества, хорошо растворимые в воде. Остальные гидроксикислоты при комнатных условиях кристаллические вещества. Растворимость их в воде несколько лучше, чем у соответствующих карбоновых кислот.
Химические свойства
Присутствие в молекулах гидроксикислот двух функциональных групп обуславливает их реакции как спиртов и кислот. Естественно, взаимное влияние гидроксила и карбоксила накладывает отпечаток на их свойства. Особенно ярко это влияние проявляется когда обе группы находятся по соседству, т.е. в α-гидроксикислотах.
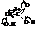
Дополнительный сдвиг электронной плотности в сторону гидроксила значительно увеличивает силу кислоты по сравнению с кислотами жирного ряда с тем же числом углеродных атомов. Например, константа диссоциации. гликолевой кислоты (СН2ОН–СООН – 1,76·10-5) в 8,5 раз больше, чем уксусной (СН3–СООН 1,48·10-4).
Вступление в реакцию спиртового или кислотного гидроксила определяется условиями реакции и природой реагента. Действие галогеноводородных кислот приводит к замещению спиртового гидроксила. Под действием пятихлористого фосфора реагируют оба гидроксила одновременно (спиртовой и кислотный). Со щелочами в первую очередь образуются соли кислот, а затем уже алкоголяты. Как спирты гидроксикислоты образуют алкоголяты, простые эфиры, могут замещать гидроксил на другие группы. Как кислоты они дают соли, сложные эфиры, амиды и т.д.
Рассмотрим некоторые особые реакции, протекание которых возможно только благодаря одновременному присутствию в молекуле гидроксильной и карбоксильной групп.
– α-Гидроксикислоты легко восстанавливаются в карбоновые кислоты
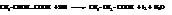
– Гидроксикислоты более или менее легко отщепляют воду при нагревании, причём в зависимости от положения гидроксила образуются совершенно различные продукты.
α-Гидроксикислоты при нагревании легко отщепляют воду с образованием циклических сложных эфиров – лактидов. При этом гидроксильные и карбоксильные группы двух молекул взаимно этерифицируются
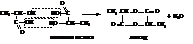
β-Гидроксикислоты при нагревании отщепляют воду и дают ненасыщенные кислоты
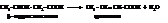
В γ- и δ-гидроксикислотах, а также в гидроксикислотах с более удаленным расположением гидроксила благодаря внутреннему вращению в достаточно длинной углеродной цепочке возможно пространственное сближение групп –ОН спирта и карбоксила. При дегидратации они образуют внутренние циклические сложные эфиры – лактоны.
9.2 Оптическая изомерия органических соединений
Ранее были описаны структурная изомерия, обусловленная различным порядком чередования атомов и связей в молекулах, и два вида пространственной изомерии: поворотной и геометрической
(цис-транс), связанные с различным расположением фрагментов молекул одинаковой структуры в пространстве. Существует ещё один вид стереоизомерии – оптическая изомерия.
Оптические изомеры одинаковы по всем своим физическим и химическим свойствам и различаются лишь в двух отношениях.
1 При кристаллизации они образуют кристаллы, не имеющие плоскости симметрии и относящиеся друг к другу как предмет к своему зеркальному отображению. Это свойство позволило Пастеру открыть явление оптической изомерии. При кристаллизации винной кислоты он визуально обнаружил кристаллы двух различных типов и разделив их, выделил чистые стереоизомерные формы винной кислоты.
2 Оптические изомеры по разному относятся к поляризованному свету.
В луче света колебания электрического и магнитного векторов происходят во взаимно-перпендикулярных направлениях, а также перпендикулярно направлению распространению луча. Причём направление колебаний, например, электрического вектора хаотически меняется во времени, изменяя соответственно направление колебания вектора магнитного. В поляризованном луче колебания электрического и магнитного векторов совершаются для каждого в одной строго фиксированной плоскости, плоскости поляризации. При прохождении поляризованного луча через некоторые прозрачные жидкие и кристаллические вещества плоскость поляризации поворачивается. Соединения, вращающие плоскость поляризации поляризованного луча, называются оптически деятельными или оптически активными. Для количественного сравнения оптической деятельности различных веществ, вычисляют величину удельного вращения. Поскольку величина угла, вращения плоскости поляризации света помимо природы вещества зависит еще от температуры, длины волны света, толщины слоя вещества, через который проходит поляризованный свет, а для растворов ещё от растворителя и концентрации вещества, удельное вращение при постоянной температуре и длине волны света равно
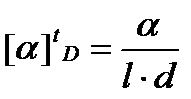 ,
,
где α – угол поворота плоскости поляризации при толщине слоя l и плотности вещества d, t – температура, D – фиксированная длина волны желтой линии из спектра натрия.
Для раствора
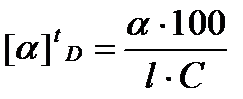 ,
,
где С – концентрация раствора в граммах вещества, на 100 мл раствора.
Молочная кислота, получаемая при ферментации сахарозы с помощью бактерий, вращает плоскость поляризации света влево (против часовой стрелки). Она называется левовращающей или левой молочной кислотой и обозначается: (–) – молочная кислота.
Молочная кислота, вращающая плоскость поляризации света вправо, называется правой молочной кислотой и обозначается: (+) – молочная кислота. Эта оптическая форма молочной кислоты выделяется из мышц животных и называется мясомолочной кислотой.
В кристаллической фазе оптическая активность вещества связана с асимметрией строения кристалла. В жидкой и газовой фазах она связана с асимметрией молекул. В 1874 г. Вант-Гофф и Лебель – основоположники стереохимической теории – почти одновременно отметили, что оптически активные вещества содержат в своих молекулах хотя бы один углерод, связанный с четырьмя различными группами. Такие атомы углерода называются асимметрическими. Наличие в структуре молекулы асимметрического атома углерода является признаком асимметрии молекул соединения, а следовательно, и оптической активности вещества.
При рассмотрении оптической изомерии асимметрические атомы углерода обычно отмечают звездочкой (*):
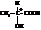
| молочная кислота |
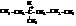
| 3-метилгексан |
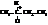
| 2-хлорбутан |

| 2-метилбутанол-1 и др. |
Как видно из структурных формул, соединения, содержащие асимметрический атом углерода, не имеют плоскости симметрии.
Оптические изомеры молочной кислоты, т.е. (–) и (+)-формы этой кислоты, имеют различное пространственное расположение отдельных групп в молекуле и являются зеркальными отображениями друг друга. Отражение в зеркале всякого предмета, не имеющего плоскости симметрии, не тождественно предмету, а представляет собой его антипод (энантиомер).
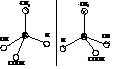
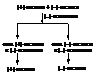
Например, отражение человеческой фигуры в зеркале не тождественно оригиналу. Левая сторона человека представляется в зеркале как правая и наоборот. Из рисунка видно, что правая модель при наложении в пространстве не совмещается с левой. Это свойство объекта быть несовместимым со своим отображением в плоском зеркале обычно называют хиральностью.
Оптические изомеры, являющиеся зеркальным отражением друг друга называются антиподами (энантиомерами). Они вращают плоскость поляризации в разные стороны на одинаковые углы.
Молочная и мясомолочная кислоты являются антиподами (энантиомерами). Эти стереоизомеры вращают плоскость поляризации в разные стороны на одинаковые углы.
Смесь равных количеств антиподов является оптически недеятельной из-за компенсации вращения и называется рацематом.
Так, молочная кислота, полученная синтетически, не влияет на поляризованный свет. Она состоит из смеси равных количеств левой и правой форм, является оптически недеятельной и обозначается (±) – молочная кислота.
Для удобства изображения пространственного строения оптически деятельных соединений введены так называемые проекционные формулы, предложенные Фишером, получаемые проецированием тетраэдрических моделей молекул на плоскость чертежа
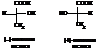
При пользовании ими следует помнить, что перемещение проекционных формул, наложение их друг на друга разрешается только в плоскости чертежа. Подразумевается также, что группы сверху и снизу находятся за плоскостью чертежа, боковые – перед ней. Проекционные формулы правой и левой молочных кислот при соблюдении этих правил естественно не совмещаются.
Очень важным моментом оптической изомерии является то, что величина и направление вращения плоскости поляризации света не находятся в прямой очевидной зависимости от конфигурации (пространственного строения) соединения.
Например, сложные и простые эфиры, правой молочной кислоты, имея такую же конфигурацию, как и сама кислота, обладают левым вращением.
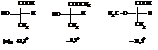
Отсюда следует, что знак вращения одного из членов ряда сходных по химическому строению веществ не может ещё служить характеристикой конфигурации и знака вращения остальных его членов.
Возникает вопрос, известны ли конфигурации оптических изомеров для различных веществ и как они определяются. Химические методы не позволяют установить абсолютную (истинную) конфигурацию антиподов из-за тождественности химических свойств антиподов. В то же время этими методами можно определить относительную конфигурацию оптических изомеров. Оптически активные соединения химическим путём можно превращать друг в друга без нарушения конфигурации. Тогда, если известна конфигурация исходного «эталонного» соединения, получаемое из него соединение будет иметь ту же конфигурацию.
В 1891 г. Фишер, а в 1906 г. Розанов предложили использовать в качестве такого относительного стандарта правый (+)–глицериновый альдегид. Ему произвольно приписали конфигурацию «D». Его антиподу, (–)-глицериновому альдегиду, соответственно дана конфигурация «L».

При этом появилась возможность устанавливать относительную конфигурацию оптических стереоизомеров химическим путём. В этом случае производным D(+)-глицеринового альдегида приписывается
D-относительная конфигурация.
Например, относительная конфигурация молочной кислоты была установлена превращением глицеринового альдегида в молочную кислоту.
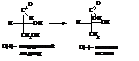
Оказалось, что D(+)-глицериновому альдегиду по конфигурации соответствует левая D(–)-молочная кислота.
Лишь в 1951 году рентгеноскопическим анализом была установлена абсолютная конфигурация D-глицеринового альдегида. Оказалось, что выбор его конфигурации был правилен. Таким образом, абсолютные конфигурации многих веществ в настоящее время стали известны.
Кроме описанной DL-номенклатуры для обозначения конфигурации оптических стереоизомеров используется так называемая RS-номенклатура Кана, Ингольда, Прелога, не связанная с конфигурацией опорного соединения («стандарта»). Она описана в учебной литературе.
Молочная кислота, СН3–СНОН–СООН
Молочную кислоту получают из нитрила молочной кислоты или молочнокислым брожением сахаристых веществ.
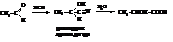
Используют её в кожевенном производстве и при крашении тканей.
Яблочная кислота

Это двухосновная, трёхатомная кислота. В химическом отношении она обнаруживает свойства α- и β-гидроксикислот, так как гидроксил по отношению к одной кислотной группе находится в α-положении, а по отношению к другой – в β-положении. При восстановлении она даёт янтарную кислоту, при дегидратации – малеиновую или фумаровую:
HOOC – CH – CH – COOH → HOOC – CH = CH – COOH + H2O
׀ ׀
H OH
В яблочной кислоте имеется один асимметрический атом углерода, она оптически активна.
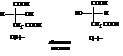
Левая и правая яблочные кислоты плавятся при 100 °С. Рацемат – при 130–131 °С. В природе встречается левая форма яблочной кислоты: в рябине, яблоках, винограде.
Винные кислоты (дигидроксиянтарные)
Они имеют одинаковую структурную формулу
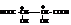
и различаются пространственным строением.
Как следует из формулы, винная кислота имеет два асимметрических атома углерода. Число оптических изомеров для соединений, имеющих в структуре молекулы несколько асимметрических атомов углерода, находится по формуле N=2n , где n – число асимметрических атомов углерода.
Следовательно, для винной кислоты следует ожидать существования четырёх оптических стереоизомеров:
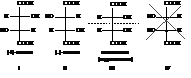
В соответствии с правилами обращения с проекционными формулами, при наложении последних двух форм друг на друга они оказываются идентичными (одну из форм следует повернуть в плоскости чертежа на 180°). Таким образом, вместо четырех стереоизомерных форм винная кислота реализуется в трех. Кроме того, третий стереоизомер (III) оказывается оптически недеятельным из-за своей симметрии (на рисунке показана плоскость симметрии): вращение плоскости поляризации света, вызываемое верхним тетраэдром, полностью компенсируется равным по величине, но противоположным по знаку вращением нижнего. Перед нами пример стереоизомерной формы с асимметрическими углеродными атомами оптически недеятельной вследствие ее симметрии. Такие стереоизомеры называют мезоформами.
Стереоизомеры вещества, не являющиеся зеркальным отображением друг друга, называются диастереоизомерами. В соответствии с этим определением, первая и вторая пространственные формы винной кислоты являются диастереомерами по отношению к мезовинной кислоте (и наоборот).
Поскольку антиподы имеют одинаковое (только зеркально обратное) строение, их свойства за исключением отношения к поляризованному свету тоже одинаковы. Диастереомеры не одинаковы по своему пространственному строению, поэтому их свойства несколько различаются.
Заключая анализ пространственной изомерии винной кислоты, можно сказать, что она представлена двумя антиподами (формы I и II), их рацематом, называемым виноградной кислотой, и диастереоизомерной мезоформой (III).
Правовращающая, (+)-винная кислота весьма распространена в природе, особенно её много в соке винограда. При брожении виноградного сока она выделяется в виде винного камня, состоящего из кислого виннокислого калия.

Эта соль применяется в качестве протравы при крашении и печатании тканей.
Другая, калий-натриевая соль (+)-винной кислоты – так называемая сегнетова соль,

используется в качестве пьезокристалла в радиотехнике. Она входит в состав фелинговой жидкости, которая употребляется для аналитического определения восстановителей (например, альдегидов).
Мезовинная кислота получается вместе с виноградной при кипячении в течении нескольких часов (+)-винной кислоты с избытком едкого натра.
Лимонная кислота
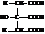
Она довольно часто встречается в природе: в свекле, крыжовнике, винограде, лимонах, малине, листьях табака. Оптически недеятельна.
Лимонная кислота используется в пищевой промышленности, при крашении, в фотографии, для консервирования крови и т.д.
Альдоновые кислоты
Альдоновые кислоты – это полигидроксикарбоновые кислоты общей формулы HOCH2[CH(OH)]nCOOH, формально являющиеся продуктами окисления альдегидной группы углеводов (альдоз). Наиболее типичным лабораторным методом синтеза альдоновых кислот является окисление легкодоступных альдоз бромом в его водном растворе.
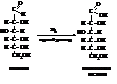
Альдоновые кислоты и их производные играют важную роль в синтетической химии моносахаридов.
Методы разделения рацематов на оптически активные компоненты
В настоящее время стремительно растет потребность в энантиомерно чистых веществах для получения современных высокоэффективных медицинских препаратов, а также нужд сельского хозяйства и защиты лесов: получения новых высокоактивных инсектицидов, гербицидов, фунгицидов и других веществ избирательного действия для борьбы с вредными организмами. Получение энантиомерно чистых веществ для этих целей возможно либо на путях разработки методик их полного химического синтеза (ряд достижений в этой области отмечен присуждением Нобелевских премий по химии), либо разделением рацемических смесей. Рассмотрим принципы некоторых методов разделения рацематов на оптически активные компоненты.
– Механический отбор. При кристаллизации рацематы иногда кристаллизуются отдельно в виде правой и левой форм. Причем их кристаллы по форме относятся друг к другу как предмет к своему зеркальному отражению. В этом случае их можно отобрать механически по внешнему виду.
– Биохимическое разделение. Оно основано на том, что микроорганизмы в процессе своей жизнедеятельности способны потреблять предпочтительно лишь один из оптических изомеров. Обычно эта оптическая форма более распространена в природе. Поэтому при размножении и прорастании грибков в растворе рацемата через некоторое время остается только одна оптически активная форма.
– Способы, основанные на различии свойств диастереомеров
Так, соли антиподов оптически деятельной кислоты с одним и тем же оптически деятельным основанием должны давать диастереомеры различной растворимости. Это позволяет разделить их кристаллизацией.
9.3 Ароматические гидроксикислоты (фенолокислоты)
Наибольшее значение имеет орто-гидроксибензойная или салициловая кислота.
Получают её действием СО2 под давлением на фенолят натрия:
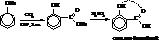
Салициловая кислота значительно сильнее бензойной: образование водородной связи между водородом фенольной и кислородом кислотной групп существенно повышает положительный заряд на атоме углерода карбоксила и тем самым – силу кислоты.
Салициловая кислота образует два ряда производных (по обеим функциональным группам):
– с галогенангидридами и ангидридами она реагирует по фенольной группе:
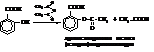
– хлорангидрид салициловой кислоты образует с фенолами или спиртами сложные эфиры по карбоксилу
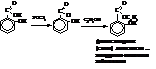
В больших масштабах салициловая кислота используется в производстве красителей и лекарственных препаратов. Вот, например, широко известные лекарства
Из полигидроксикарбоновых кислот наиболее известна
3,4,5-тригидроксибензойная или галловая кислота.
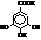
Она входит в состав природных дубильных веществ, находится в чае, чернильных орешках.
Танины, извлекаемые из дубильных орешков, представляют собой глюкозу, ацилированную галловой кислотой.
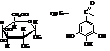
Дубильные вещества – это органические соединения растительного происхождения, имеющие вяжущий вкус. Особенно много их в коре дуба. Применяются, например, для дубления сырых кож. Дубление с химической точки зрения – процесс соединения дубильных веществ с белками кожи (денатурация белков). Отсюда: «дубленка». При этом образуется термически и химически стойкий слой, трудно проницаемый для воды и газов. Получены и синтетические дубители.
В медицине дубильные вещества употребляются как противоядие при отравлении алкалоидами, желудочно-кишечных заболеваниях, при ожогах (таннин) и т.д. Большое значение имеют дубильные вещества в пищевой промышленности, где они нередко определяют характер переработки и вкусовые достоинства готового продукта. Например, производство черного чая основано на превращении дубильных веществ, содержащихся в молодых побегах чайного растения. От правильно проведенного окисления дубильных веществ при ферментации зависит в основном цвет, вкус и аромат чая. Дубильные вещества используются также в производстве какао и ряда других пищевых продуктов.
| <== предыдущая страница | | | следующая страница ==> |
| АРОМАТИЧЕСКИЕ ДИАЗО- И АЗОСОЕДИНЕНИЯ, КРАСИТЕЛИ | | | АМИНОКИСЛОТЫ, ПОЛИПЕПТИДЫ |
Дата добавления: 2014-10-02; просмотров: 1210; Нарушение авторских прав

Мы поможем в написании ваших работ!