
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Химические реакции делятся на обратимые и необратимые
Химически необратимые реакции при данных условиях идут практически до конца, до полного расхода одного из реагирующих веществ (NH4NO3 → 2H2O + N2O – никакая попытка получить нитрат из Н2О и N2O не приводит к положительному результату).
Химически обратимые реакции протекают одновременно при данных условиях как в прямом, так и в обратном направлении. Необратимых реакций меньше, чем обратимых. Примером обратимой реакции служит взаимодействие водорода с иодом:
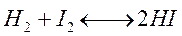
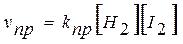 ;
; 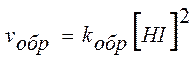 .
.
Через некоторое время скорость образования HI станет равной скорости его разложения:
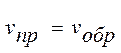 ;
; 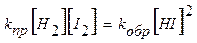 .
.
Иными словами, наступит химическое равновесие:
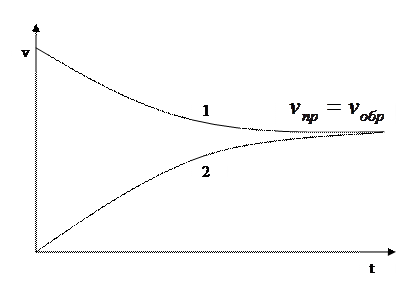
Рис. 5.7. Изменение скорости прямой (1) и обратной (2) реакций
с течением времени.
Химическим равновесием называется состояние системы, при котором скорость образования продуктов реакции равна скорости их превращения в исходные реагенты.
Химическое равновесие является динамическим, то есть его установление не означает прекращения реакции.
Признаки истинного химического равновесия:
1. состояние системы остается неизменным во времени при отсутствии внешних воздействий;
2. состояние системы изменяется под влиянием внешних воздействий, сколь малы бы они ни были;
3. состояние системы не зависит от того, с какой стороны она подходит к равновесию.
На основании равенства скоростей прямой и обратной реакций при равновесии можно записать:

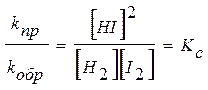 .
.
Таким образом видим, что при установившемся равновесии произведение концентраций продуктов реакции, деленное на произведение концентраций исходных веществ, в степенях, равных соответствующим стехиометрическим коэффициентам, для данной реакции при данной температуре представляет собой постоянную величину, называемую константой равновесия.
| <== предыдущая страница | | | следующая страница ==> |
| Закон действующих масс | | | В общем виде для реакции |
Дата добавления: 2014-04-24; просмотров: 363; Нарушение авторских прав

Мы поможем в написании ваших работ!