
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Осмотическое давление
Если раствор и растворитель разделены полупроницаемой (т.е. проницаемой только для растворителя) мембраной, то растворитель проникает в раствор, преодолевая избыточное давление, до достижения равновесного его значения – осмотического давления.
Осмотическое давление не зависит от природы растворителя и растворенного вещества, оно пропорционально молярной концентрации раствора СМ и абсолютной температуре Т:
р осм = СМ ×R×T,
где R – универсальная газовая постоянная. Подставляя в это выражение СМ=n/V, где n – химическое количество растворенного вещества, моль; V – объем раствора , л, получаем уравнение, аналогичное уравнению газового состояния:
росм×V = n×R×T.
Закон Вант-Гоффа: осмотическое давление численно равно тому давлению, которое оказывало бы растворенное вещество, если бы оно при данной температуре находилось в состоянии идеального газа и занимало объем равный объему расвтора.
При определении молярной массы растворенного вещества по величине осмотического давления используют соотношение:
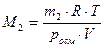 ,
,
где m2 масса растворенного вещества, г; V – объем раствора, л.
Литература
1. Глинка Н.Л. Общая химия. – М.: Химия, 1978. – С. 202-227.
2. Шиманович И.Е., Павлович М.Л., Тикавый В.Ф., Малашко П.М. Общая химия в формулах определениях, схемах. – Мн.: Унiверсiтэцкае, 1996. – С. 115-121.
3. Воробьев В.К., Елисеев С.Ю., Врублевский А.В. Практические и самостоятельные работы по химии. – Мн.: УП «Донарит», 2005. – С. 46-52.
Тема 7. Водные растворы электролитов
Рассматриваемые вопросы:
1. Электролитическая диссоциация и причины ее возникновения.
2. Сильные и слабые электролиты.
3. Гидролиз солей.
Электролитами называются вещества, которые в расплавленном или растворенном состоянии проводят электрический ток.
Теорию электролитической диссоциации разработал Сванте Аррениус. Предложенная им теория объяснила поведение и многие свойства электролитов.
Согласно этой теории молекулы электролита в воде или другой среде, характеризующейся большой диэлектрической проницаемостью*, распадаются на ионы – положительные (катионы) и отрицательные (анионы).
Процесс распада вещества на ионы получил название электролитической диссоциации. Для слабых электролитов она протекает обратимо и выражается следующим примерным уравнением
КА <=> К++А-.
К электролитам относятся вещества, в молекулах которых атомы связаны сильно полярной или ионной химической связью.
По современным представлениям электролитическая диссоциация в растворе происходит в результате сложного физико–химического взаимодействия молекул электролита с полярными молекулами растворителя.
Взаимодействие ионов с полярными молекулами растворителя называется сольватацией (для водных растворов - гидратацией) ионов. Сольватация приводит к образованию в растворе ассоциаций между ионами (катионами и анионами) и молекулами растворителя. Процесс растворения вещества К+А- в воде, являющегося соединением с типичной ионной связью, может быть записан следующим образом:
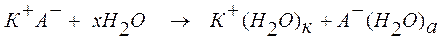 .
.
твердое жидкий раствор
вещество растворитель
Электролитическая диссоциация полярных молекул (КА) в растворе происходит вследствие ослабления связи, вызванного действием полярных молекул растворителя:
КА + хН2О <=> К+(Н2О)к + А-(Н2О)а.
Ассоциации К+(Н2О)к и А-(Н2О)а представляют собой гидратированные катионы и анионы.
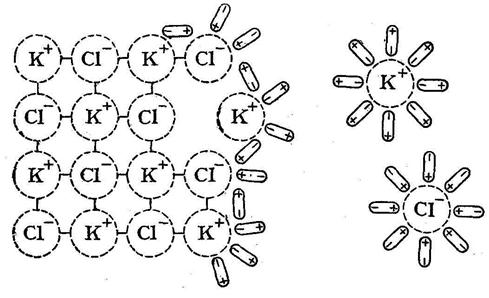
Немаловажное значение имеет величина диэлектрической проницаемости растворителя: чем больше последняя, тем больше ослабляются связи между ионами электролита. Это вытекает из формулы закона Кулона 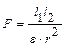 , где F – сила взаимодействия между зарядами l1 и l2, r расстояние между центрами ионов, ε – диэлектрическая проницаемость растворителя. Для воды при 20° ε = 80, то есть сила притяжения ионов в водном растворе ослабляется в 80 раз.
, где F – сила взаимодействия между зарядами l1 и l2, r расстояние между центрами ионов, ε – диэлектрическая проницаемость растворителя. Для воды при 20° ε = 80, то есть сила притяжения ионов в водном растворе ослабляется в 80 раз.
Если в растворе дополнительно могут возникнуть еще и водородные связи между молекулами растворителя и атомом водорода растворенного вещества, то процесс диссоциации протекает еще более эффективно.
С точки зрения теории электролитической диссоциации кислотой называется соединение, диссоциирующее в водном растворе с образованием гидратированных водородных ионов (гидроксоний-ионов) и кислотного остатка:
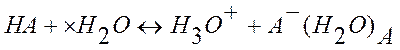 ,
,
где Н3О+ - ион гидроксония.
Все общие свойства кислот (кислый вкус, способность изменять окраску индикаторов и т.д.) принадлежат иону гидроксония.
Основанием называется соединение, диссоциирующее в водном растворе с образованием отрицательных гидроксид–ионов ОН-:
МеОН + хН2О <=> Ме+(Н2О)к + ОН- + (х-к)Н2О,
где Ме+ - одновалентный катион.
Все общие свойства растворимых оснований (щелочно–мыльный вкус, способность определенным образом изменять окраску индикаторов и т.д.) принадлежат гидроксид–иону.
С точки зрения электролитической диссоциации соли можно рассматривать как продукт взаимодействия кислоты и основания:
х(кислота) + у(основание) → соль + вода,
где х и у – переменное количество эквивалентов взаимодействующих между собой кислот и оснований.
В зависимости от соотношения х и у различают следующие виды солей, диссоциирующих в водных растворах по схеме:
при х > у – кислые соли
2H2SO4 + Mg(OH)2 ® Mg(HSO4)2 + 2H2O;
Mg(HSO4)2 <=> Mg2+ + 2HSO4- ;
при х = у – средние (нормальные) соли
H2SO4 + Mg(OH)2 ® MgSO4 + 2H2O;
MgSO4 <=> Mg2+ + SO42-;
при х < у – основные соли
H2SO4 + 2Mg(OH)2 ® (MgOH)2SO4 + 2H2O;
(MgOH)2SO4 <=> 2MgOH+ + SO42-;
Как правило, все соли относятся к сильным электролитам.
Сильные электролиты в водных растворах полностью диссоциированы на ионы.
В воде, являющейся растворителем, статистически равномерно распределяются полностью гидратированные катионы и анионы сильного электролита. Электростатическое взаимодействие между ионами ослабляется до минимума большими расстояниями между ними и гидратными оболочками, выполняющими экранирующую роль.
В отличие от сильных электролитов диссоциация слабых электролитов протекает обратимо и устанавливается равновесие.
Количественно процесс диссоциации может быть охарактеризован рядом величин: степенью электролитической диссоциации a, константой электролитической диссоциации К и др.
Степень электролитической диссоциации a – это отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества в растворе.
a может измеряться в долях единицы или в процентах. a = 0, если диссоциация отсутствует; a = 1 или a = 100 % при полной диссоциации электролита.
К процессу электролитической диссоциации, как к обратимому процессу, можно применять принцип Ле Шателье и выявить влияние внешних факторов на состояние равновесия, приводящее к изменению значения a.
Для смещения равновесия
К+А- + хН2О <=> К+(Н2О)к + А-(Н2О)а
слева направо, то есть в сторону диссоциации, необходимо увеличить массу растворителя. Это означает, что:
1. диссоциация слабых электролитов проходит эффективнее в разбавленных растворах, чем в концентрированных. Иными словами, a возрастает с уменьшением концентрации электролита в растворе и принимает максимальное значение a = 1 в бесконечно разбавленном растворе.
2. так как процесс диссоциации является эндотермическим, то степень диссоциации слабого электролита в водных растворах будет увеличиваться с повышением температуры.
Константой электролитической диссоциации К называется постоянная химического равновесия в растворе электролита:
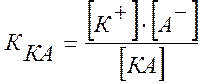 ,
,
где [К+], [A-] и [KA] - концентрации в растворе ионов 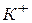 и
и 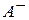 (в г-ион/л) и недиссоциированного соединения КА (в моль/л).
(в г-ион/л) и недиссоциированного соединения КА (в моль/л).
Чем больше К, тем электролит лучше распадается на ионы. Для данного электролита значение К постоянно при определенной температуре и в отличие от a не зависит от концентрации.
Связь между константой К и степенью диссоциации a может быть найдена следующим образом. Концентрация ионов К+ и А- в растворе равна
[К+] = [А-] = aС,
где С – исходная молярная концентрация; a – степень электролитической диссоциации электролита. Концентрация недиссоциировавших молекул КА в растворе равна
[КА]=(1- a)С.
Откуда 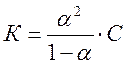 .
.
Данное уравнение выражает закон разбавления Оствальда.
Если a мала, то 1- a ≈ 1 и тогда
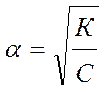 .
.
Видно, что с уменьшением концентрации электролита в растворе степень электролитической диссоциации возрастает.
Диссоциация слабого электролита, молекула которого может диссоциировать не на два, а на большее количество ионов (электролиты с разновалентными ионами), протекает по стадиям (ступенчатая диссоциация). Например, при диссоциации слабой угольной кислоты Н2СО3 в водном растворе имеют место следующие равновесия:
I стадия: Н2СО3 <=> Н+ + НСО3-
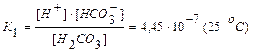 .
.
II стадия: НСО3- <=> Н+ + СО32-
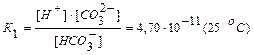 .
.
Как видно из этих данных, процесс диссоциации слабого электролита с разновалентными ионами определяется главным образом первой ступенью.
Для примера приведем константы электролитической диссоциации некоторых слабых кислот и оснований (25 °С):
| СН3СООН | <=> | H+ + CH3COO- | 1,76·10-5 |
| NH4OH | <=> | NH4+ + OH- | 1,79·10-5 |
| HNO2 | <=> | H+ + NO2- (18 °C) | 4·10-4 |
| H2S | <=> | H+ + HS- | 6·10-8 |
| H3PO4 | <=> | H+ + H2PO4- | 7,52·10-3 |
| HF | <=> | H+ + F- | 6,61·10-4 |
| HCN | <=> | H++CN- | 7,9·10-10 |
| <== предыдущая страница | | | следующая страница ==> |
| Второй закон Рауля | | | Ионообменные реакции |
Дата добавления: 2014-04-24; просмотров: 630; Нарушение авторских прав

Мы поможем в написании ваших работ!