
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Второй закон Рауля
Наряду с понижением давления пара изменяются также температуры кипения и замерзания указанных растворов. Растворы кипят при более высокой температуре, а замерзают – при более низкой, по сравнению с соответствующими температурами для чистого растворителя.
При кипении давление пара жидкости становится равным внешнему давлению. Из-за понижения давления пара раствора его надо нагреть до более высокой температуры, чем растворитель, чтобы давление его пара достигло внешнего давления и раствор мог закипеть.
Для выделения кристаллов льда из раствора последний должен быть охлажден до некоторой температуры, лежащей ниже температуры замерзания воды.
Таким образом, при растворении в воде вещества пределы жидкого состояния раствора расширены по сравнению с растворителем на число градусов, равное сумме повышения температуры кипения раствора Dtкип. и понижения его температуры замерзания Dtзам.. Значения величин Dtкип. и Dtзам пропорциональны моляльности раствора. Одномоляльные растворы различных веществ (неэлектролитов) характеризуются определенной для данного растворителя величиной повышения температуры кипения и, соответственно, понижения температуры замерзания.
Повышение температуры кипения одномоляльного раствора называется эбулиоскопической постоянной растворителя Екип, а понижение температуры замерзания – криоскопической постоянной растворителя Езам. Таким образом, в соответствии со вторым законом Рауля повышение температуры кипения или понижение температуры замерзания разбавленных растворов неэлектролитов пропорциональны числу частиц растворенного вещества и не зависят от его природы:
Dtкип = Екип · m,
Dtзам = Езам · m;
где Екип и Езам – коэффициенты пропорциональности, соответственно - эбулиоскопическая и криоскопическая константы, зависящие только от природы растворителя. Для воды Езам = 1,86; Екип = 0,516; m – моляльность раствора.
Для случая, когда g г неэлектролита, молярная масса которого М, растворены в А г растворителя можно записать:
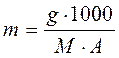 и
и 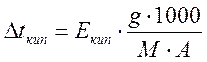 ;
; 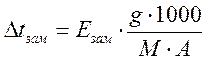 .
.
Из этого выражения видно, что в соответствии с физическим смыслом эмбулиоскопической и криоскопической констант
Dtкип = Екип. и Dtзам. = Езам, когда g = М и А = 1000 г.
| <== предыдущая страница | | | следующая страница ==> |
| Первый закон Рауля | | | Осмотическое давление |
Дата добавления: 2014-04-24; просмотров: 415; Нарушение авторских прав

Мы поможем в написании ваших работ!