
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Давление насыщенного пара над раствором. I закон Рауля
 В результате естественного процесса испарения над жидкостью образуется пар, давление которого можно измерить с помощью манометра (рис. 8.1). Эндотермический процесс испарения обратим; одновременно с ним протекает экзотермический процесс конденсации:
В результате естественного процесса испарения над жидкостью образуется пар, давление которого можно измерить с помощью манометра (рис. 8.1). Эндотермический процесс испарения обратим; одновременно с ним протекает экзотермический процесс конденсации:
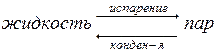
При равновесии (∆G=0) Vисп=Vконд. Каждый раствор находится в равновесии с его насыщенным паром. Давление насыщенного пара каждого вещества есть величина постоянная при данной температуре, с повышением температуры давление пара увеличивается.
Давление насыщенного пара жидкости определяется числом молекул жидкости, отрывающихся с ее поверхности за единицу времени.
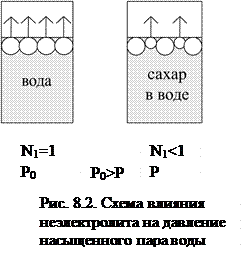
Рассмотрим пример (рис.8.2). В первом сосуде у нас находится чистая вода, во втором – раствор сахара в воде (раствор неэлектролита; сахар -- нелетучее вещество и при данных условиях не испаряется).
| |
|
Однако основную роль здесь играют силы сольватационного взаимодействия между молекулами растворителя и растворенного вещества. Эти силы значительно прочнее сил сцепления между молекулами растворителя, чем и объясняется переход меньшего числа молекул растворителя в газовую фазу.
Таким образом, над раствором давление насыщенного пара растворителя (Р) всегда меньше, чем над чистым растворителем (Р0): Р < Р0. (Р0 – Р)=∆P – понижение давления насыщенного пара растворителя над раство-
ром. Отношение 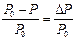
 называется относительным понижением давления насыщенного пара растворителя.
называется относительным понижением давления насыщенного пара растворителя.
В 1887 г. французский ученый химик Франсуа Рауль установил I закон: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
Математическая запись I закона Рауля:
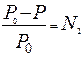 или
или 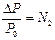 ,
, 
где N2 – мольная доля растворенного вещества.
Выразив мольную долю растворенного вещества N2 через соотношение
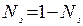 ,
,
подставим данное равенство в выражение I закона Рауля, выполнив необходимые преобразования, получим второй вариант записи I закона Рауля:
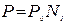 ,
,
где N1 – мольная доля растворителя.
Т.е. давление насыщенного пара над раствором равно его давлению над чистым растворителем, умноженному на мольную долю растворителя.
Кипение и замерзание растворов неэлектролитов. II закон Рауля.
Следствием понижения давления насыщенного пара растворителя над раствором будет:
· понижение температуры замерзания раствора;
· повышение температуры кипения раствора.
Рассмотрим диаграмму состояния воды и раствора неэлектролита. На рис.8.3 схематически изображена зависимость равновесного давления водяного пара от температуры над чистой водой и раствором.
При температуре кипения давление пара равно внешнему давлению, при температуре замерзания давление пара над веществом в жидком и твердом состояниях одинаково.
Линия АО - кривая сублимации - характеризует давление насыщенного водяного пара надо льдом, ОВ – кривая плавления или кристаллизации воды; ОС – кривая испарения или конденсации воды.
В точке О сосуществуют все три фазы воды: жидкость, пар, лед.
Линия О′С′ – кривая испарения или конденсации раствора; О′В′ – кривая плавления или кристаллизации раствора. Обозначение: t1 - температура замерзания (кристаллизации) раствора при 760 мм рт. ст.– точка В′;
t2 - температура замерзания чистой воды (0°С при 760 мм рт. ст.) – точка В; t3 - температура кипения чистой воды (100°С при 760 мм рт. ст.) – точка С; t4 - температура кипения раствора – точка С′.
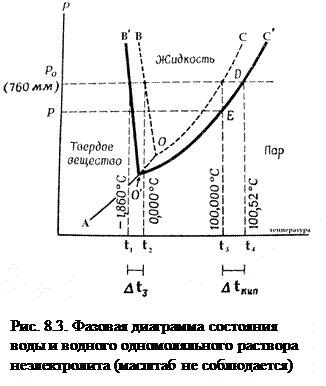 Поскольку давление насыщенного пара воды над раствором будет ниже, чем над чистой водой, то изменение его давления будет характеризоваться кривой О′С′, все точки которой располагаются ниже соответствующих точек кривой ОС для чистого растворителя, т.е. кривая кипения для раствора лежит ниже, чем для чистой воды. Из рис. 8.3 видно, что при 100°С давление насыщенного пара воды над раствором меньше атмосферного давления (точка Д), поэтому при данной температуре раствор не закипает. Равенство давлений достигается в точке С′ при температуре t4. При переходе от воды к раствору изменяется также положение кривой плавления. И кривая кипения, и кривая плавления раствора расположены тем дальше от соответствующих кривых воды, чем концентрированнее раствор.
Поскольку давление насыщенного пара воды над раствором будет ниже, чем над чистой водой, то изменение его давления будет характеризоваться кривой О′С′, все точки которой располагаются ниже соответствующих точек кривой ОС для чистого растворителя, т.е. кривая кипения для раствора лежит ниже, чем для чистой воды. Из рис. 8.3 видно, что при 100°С давление насыщенного пара воды над раствором меньше атмосферного давления (точка Д), поэтому при данной температуре раствор не закипает. Равенство давлений достигается в точке С′ при температуре t4. При переходе от воды к раствору изменяется также положение кривой плавления. И кривая кипения, и кривая плавления раствора расположены тем дальше от соответствующих кривых воды, чем концентрированнее раствор.
∆tкип = t4 – t3 = (tкип.р-ра – tкип.р-ля) – повышение температуры кипения раствора по сравнению с температурой кипения растворителя.
∆tзам = t2 – t1 = (tзам.р-ля – tзам.р-ра) – понижение температуры замерзания (кристаллизации) раствора по сравнению с температурой замерзания растворителя.
Зависимость ∆tкип и ∆tзам от концентрации растворов определяется вторым законом Рауля:
повышение температуры кипения и понижение температуры замерзания растворов пропорциональны моляльной концентрации растворенного вещества, т.е.
∆tкип = Кэб · Сm,
∆tзам = Ккр ·Сm ,
где Кэб – коэффициент пропорциональности, называемый эбуллиоскопической постоянной растворителя; Ккр – криоскопическая постоянная растворителя; Сm – моляльная концентрация растворенного вещества, моль/кг. Физический смысл Кэб и Ккр: если Сm= 1 моль/кг, то ∆tзам= Ккр, т.е. Ккр – понижение tзам раствора, моляльность которого равна 1 моль/кг; ∆tкип= Кэб, т.е. Кэб – повышение tкип раствора, моляльность которого равна 1 моль/кг.
Кэб, Ккр – характеристики растворителя, не раствора, зависят от природы растворителя (справочные величины). Например,
для воды: для бензола:
kкр=1,86°С, Ккр=5,12°С,
kэб=0,52°С; Кэб=2,53°С.
Для одномоляльных растворов различных неэлектролитов независимо от их состава температура кипения данного растворителя повышается на одну и ту же величину, а температура замерзания – понижается на одну и ту же величину. Так, температура кипения различных по составу одномоляльных водных растворов увеличивается на 0,52°С, а температура замерзания понижается на 1,86°С.
Этот закон показывает, что свойства растворов зависят только от числа частиц растворенного вещества, но не от их размеров, природы и т.д.
Измерение понижения температуры кристаллизации раствора по сравнению с температурой кристаллизации чистого растворителя называют криоскопией. Измерение повышения температуры кипения раствора по сравнению с температурой кипения чистого растворителя называют эбуллиоскопией.
Методами криоскопии и эбуллиоскопии определяют относительные молекулярные массы растворенного неэлектролита. Для этого подставим в уравнение второго закона Рауля «развернутую» формулу для расчета моляльной концентрации растворенного вещества В
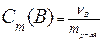 =
= 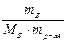 ,
,
получим:
∆tкип = Кэб · 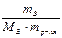 ,
,
∆tзам = Ккр · 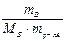 .
.
Откуда
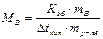 ;
;
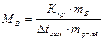 ,
,
где МВ- молярная масса растворенного неэлектролита В, численно равная его относительной молекулярной массе, mB – масса неэлектролита В, г; mр-ля – масса растворителя, кг.
| <== предыдущая страница | | | следующая страница ==> |
| Типы и свойства растворов | | | Осмос. Осмотическое давление. Закон Вант-Гоффа |
Дата добавления: 2014-09-29; просмотров: 950; Нарушение авторских прав

Мы поможем в написании ваших работ!