
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЕ И ОПТИЧЕСКИЕ СВОЙСТВА ДИСПЕРСНЫХ СИСТЕМ. Движение частиц в дисперсных системах
В свободнодисперсных системах с газовой и жидкой дисперсионной средой (аэрозоли, коллоидные растворы, газовые эмульсии, мицеллярные растворы ПАВ) дисперсные частицы не фиксированы в каких-либо позициях. Напротив, они перемещаются; кроме того, частицы могут вращаться и совершать колебания с разной амплитудой. Подвижность дисперсных частиц – фундаментальное свойство свободнодисперсных систем.
Движение дч обусловлено различными факторами и зависит главным образом от их размера. Высокодисперсные частицы благодаря своим малым размерам активно участвуют в броуновском движении.
Броуновское движение дч рассматривают как проявление молекулярно-кинетических свойств дисперсных систем.
Другое молекулярно-кинетическое свойство – диффузия дч – процесс переноса вследствие различия их концентрации в разных областях дисперсной системы. Диффузия приводит к постепенному выравниванию концентрации частиц. В соответствии со вторым началом термодинамики диффузия сопровождается увеличением энтропии дисперсной системы.
Крупные дч (твердые частицы, капли, газовые пузыри) в броуновском движении практически не участвуют. Соответственно грубодисперсные системы не обладают молекулярно-кинетическими свойствами.
Основной причиной движения крупных дисперсных частиц служит различие плотностей дф (ρd) и дс (ρо). если плотность дф больше (ρd > ρо ), частицы постепенно оседают под действием силы тяжести. Этот процесс называют седиментацией. Более легкие дч (при условии ρd < ρо), напротив, постепенно всплывают вверх. Этот процесс называют обратной седиментацией.
Седиментация твердых частиц. Седиментация – это процесс осаждения дисперсных частиц в дисперсионной среде (дс) (обычнов жидкости) под действием силы тяжести.
Седиментация – переход частиц дисперсной фазы из объема на границы раздела фаз под действием сил разной природы (гравитационной, центростремительной, электрической).
Рис.4.6. Фролов с 121.
Способность дисперсной системы сохранять во времени равномерное распределение частиц по всему объему системы называется седиментационной или кинетической устойчивостью. Седиментационной устойчивостью обладают высокодисперсные системы (аэрозоли, лиозоли) с размером частиц 1 мкм < Q < 1 нм. Грубодисперсные системы (пыль, суспензии, эмульсии) седиментационно неустойчивы.
В результате взаимодействия противоположно направленных потоков диффузии и седиментации в системе с жидкой или газообразной дисперсионной средой устанавливается седиментационное равновесие, которое определяется различными силами, действующими на частицу: силой тяжести, архимедовой силой выталкивания, силой трения, обобщенной силой, определяемой тепловым движением частиц дисперсной фазы и молекул дисперсионной среды.
Рассмотрим оседание одной частицы дисперсной фазы. 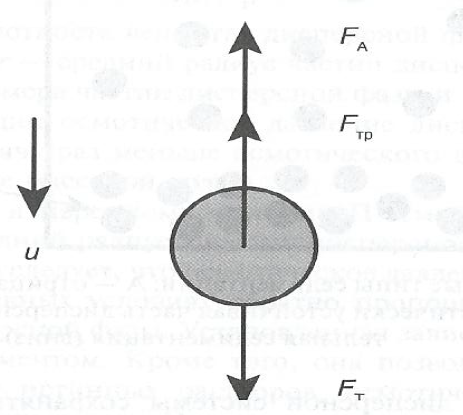
Оседание частицы в лиозоле или аэрозоле определяется суммарной силой :
FC = FT – FA – FТP,
где FT – сила тяжести, действующая на частицы; FA – выталкивающая архимедова сила; FТP – сила трения, которая тормозит движение частицы в дисперсионной среде.
Согласно 2-му закону Ньютона, оседание частицы происходит с постоянной скоростью и, когда равнодействующая всех сил FC равна нулю:
FT – FA – FТP = 0
Сила тяжести: FT = mg, где т – масса чатицы дисперсной фазы, кг; g – ускорение силы тяжести, равное 9,8 м/с2.
Выталкивающая архимедова сила FA = mжg, где mж – масса дисперсной фазы в объеме V частицы.
Массы m и mж соответственно равны m = ρV, mж = ρ0V, где V – объем частицы, ρ, ρ0 – плотности дисперсной фазы и дисперсионной среды, кг/м3. =>,
FT = ρVg, FA = ρ0Vg.
Согласно закону Стокса, сила трения, действующая на сферическую частицу, пропорциональна ее радиусу r, скорости движения и коэффициенту вязкости среды η:
FТP = 6πrηu.
Объем сферической частицы v = 4/3πr3, =>
4/3πr3(ρ - ρ0)g = 6πrηu
Скорость и оседания частиц равна
и = 2/9 ∙ r2/η ∙( ρ - ρ0)g
ð Скорость оседания частиц под действием силы тяжести прямо пропорциональна квадрату радиуса частицы, разности плотностей дисперсной фазы и дисперсионной среды и обратно пропорциональна коэффициенту вязкости среды.
На основе полученной формулы по скорости оседания можно рассчитать средний размер частиц дисперсной фазы:
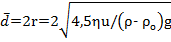 .
.
Седиментационный анализ – определение свойств дисперсионной системы на основе изучения седиментации. Одним из наиболее простых и часто используемых методов седиментационного анализа является гравиметрический метод. Он основан на определении скорости накопления осадка на чашке весов, помещенной в дисперсию.
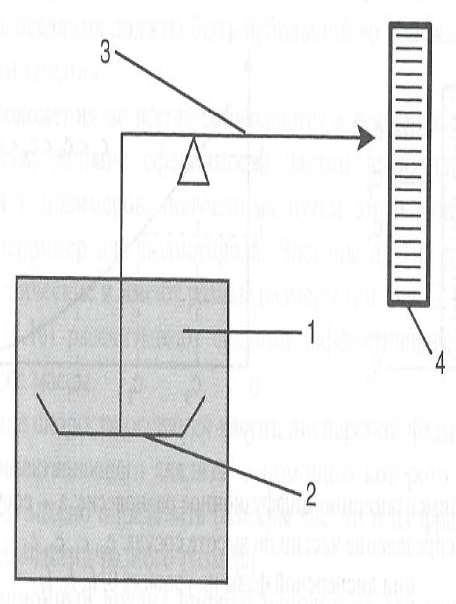
На рисунке приведена схема гравиметрического седиментометра. После тщательного перемешивания в сосуд 1 с дисперсией погружают чашку весов 2. Затем в ходе седиментации визуально или автоматически фиксируется масса mс осадка на чашке весов в разные моменты времени.
В настоящее время для изучения седиментации широко используют торсионные весы. К коромыслу которых прикрепляется чашечка для накопления осадка. Автоматизацию измерений осуществляют путем подключения приборов с пьезодатчиками, которые преобразуют измерение массы чашечки с осадком в измерение электрического сигнала. Этот сигнал отображается при помощи самописца или на мониторе компьютера.
На основе полученных данных строят седиментационную кривую – кинетическую кривую зависимости массы mс от времени t . 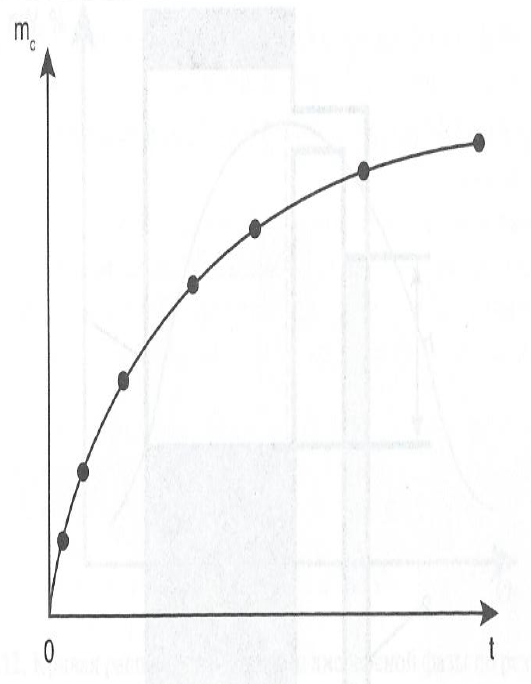 Вначале масса осадка нарастает быстро, так как оседают и крупные, и мелкие частицы. Затем накопление осадка замедляется, т.к. оседают только мелкие частицы, а крупные уже осели. Плато на кривой соответствует области седиментационного равновесия.
Вначале масса осадка нарастает быстро, так как оседают и крупные, и мелкие частицы. Затем накопление осадка замедляется, т.к. оседают только мелкие частицы, а крупные уже осели. Плато на кривой соответствует области седиментационного равновесия.
Недостаток гравиметрического анализа – неопределенность первоначального момента осаждения, что вносит погрешность и в определение конечной массы осадка. Как правило, конечная масса осадка оказывается меньше массы, рассчитанной по концентрации и объему дисперсии в сосуде над чашечкой.
Броуновское движение и диффузия дисперсных частиц. Броуновское движение – это хаотическое движение дисперсных частиц в дисперсионной среде. Его главная особенность состоит в том, что частица перемещается хаотически. Эти скачки совершаются с большой частотой в произвольном направлении, т.е. независимо от того, каким был предшествующий скачок. Кроме того, скачки имеют разную длину. Направление движения частицы может изменяться до 1020 раз в течение 1 с (рис. 2.2 Сумм).
Поскольку частица движется хаотически, то спрогнозировать точку, где окажется частица размером d за время t нельзя. Поэтому рассчитаем каким будет наиболее вероятное (среднеквадратичное) расстояние 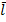 от исходной точки через время t.
от исходной точки через время t.
Перемещение дисперсной частицы при броуновском движении определяется уравнением Эйнштейна:
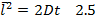
где D - коэффициент диффузии дисперсных частиц, м2/с.
Коэффициент диффузии равен массе вещества, перенесенного вследствие диффузии через единицу площади поперечного сечения стационарного диффузионного потока за единицу времени под действием единичного градиента концентрации (grad C = -1 г/см2).
Коэффициент диффузии сферической дисперсной частицы радиусом r определяется уравнением Эйнштейна:
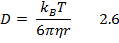
где kB – постоянная Больцмана, равная 1,38∙10-23 Дж/К; Т – температура, К; η – вязкость дисперсионной среды, Па∙с.
Движущая сила броуновского движения создается тепловыми колебаниями молекул жидкости, окружающей частицу. Средняя энергия этих колебаний в расчете на одну степень свободы равна 1/2 kBТ. силу сопротивления создает вязкое трение жидкости, которое определяется уравнением Стокса (2.2).
В соответствии с уравнением (2.6) коэффициент диффузии дисперсных частиц изменяется обратно пропорционально их размеру d = 2r. Поэтому броуновское движение и диффузия присущи именно высокодисперсным и ультрадисперсным частицам.
Коэффициент диффузии резко растет с увеличением температуры. Зависимость D = f(T) определяется возрастанием энергии тепловых колебаний kBТ. вместе с тем, вязкость жидкостей с увеличением температуры уменьшается.
Диффузия дисперсных частиц. Диффузия молекул, атомов, ионов, дисперсных частиц – один из основных процессов, происходящих в газах, жидкостях и твердых телах.
Диффузия – самопроизвольный процесс выравнивания концентрации какого-либо вещества в газе, жидкости или твердом теле.
В соответствии со 2-м началом термодинамики в-во самопроизвольно диффундирует из области с большим химическим потенциалом m1 (концентрация больше) в область с меньшим потенциалом m2 (концентрация меньше).
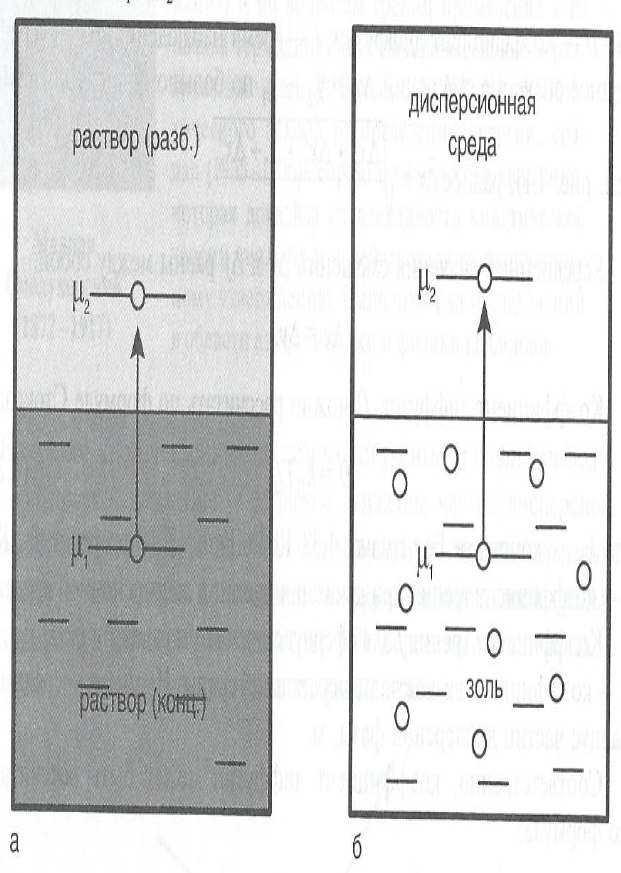 Положительный заряд в электрическом поле также самопроизвольно движется от большего потенциала к меньшему: m1 > m2.
Положительный заряд в электрическом поле также самопроизвольно движется от большего потенциала к меньшему: m1 > m2.
Диффузия дч происходит под влиянием броуновского движения и ведет к увеличению энтропии системы.
Диффузия частиц дисперсной фазы, как и молекул в растворах, описывается законом Фика, согласно которому скорость диффузии прямо пропорциональна площади поверхности, через которую проходит вещество, и градиенту его концентрации:
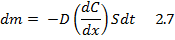
dm – масса вещества, прошедшего за время dt (с) через поверхность площадью S (м2); D – коэффициент диффузии (м2/с); с – концентрация вещества (кг/м3); dC/dx – градиент концентрации (кг/м4).
Знак « - » показывает, что диффузия идет в направлении уменьшения концентрации.
Физический смысл коэффициента диффузии D: коэффициент диффузии дисперсных частиц равен массе дисперсной фазы вещества, которое продиффундировало через единицу площади в единицу времени при градиенте концентрации, равным 1.
Коэффициент диффузии обратно пропорционален радиусу частицы r, поэтому диффузия происходит достаточно интенсивно только в ультрадисперсных и высокодисперсных системах.
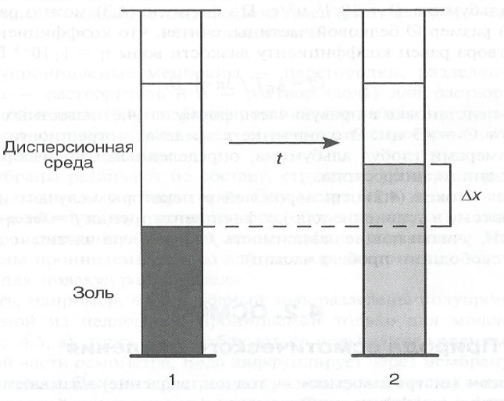
Все экспериментальные методы измерения коэффициента диффузии D основаны на приведении в контакт чистого растворителя (дисперсионной среды) с раствором (золем). При тщательном термостатировании через определенные промежутки времени отбирают пробы в разных точках системы и анализируют их, определяя концентрацию вещества. На основании этих данных рассчитывают градиент dC/dx и коэффициент диффузии по закону Фика.
Экспериментальное определение Δх осуществляют путем простого измерения смещения границы дисперсной фазы за время t в результате броуновского движения частиц в системе золь - дисперсионная среда
Осмос – преимущественная диффузия растворителя (дисперсионной среды) через полупроницаемую мембрану из раствора или золя с меньшей концентрацией в раствор или золь с большей концентрацией.
Необходимое условие осмоса – наличие растворителя и раствора или растворов различной концентрации, разделенных полупроницаемой мембраной.
В дальнейшем поток уравновешивается возникающим встречным градиентом давления. Этот процесс обусловлен, в термодинамической трактовке, ростом энтропии смешения системы, а в кинетической – избыточным числом ударов молекул растворителя о мембрану со стороны более разбавленного раствора.
Осмотическое давление жидких дисперсных систем, как и молекулярных растворов, подчиняется закону Вант-Гоффа:
П = cRT,
где с – молярная концентрация частиц дисперсной фазы, моль/л.
Осмотическое давление в дс очень мало, что связано, как и в случае диффузии, с относительно большим размером частиц. Осмотическое давление дисперсных систем определяется не количеством вещества, а числом частиц дисперсной фазы, поэтому для расчета необходимо заменить молярную концентрацию с на частичную концентрацию сν, а газовую постоянную R на константу Больцмана kB, так как cR = n kB.
Частичная концентрация – величина, измеряемая числом частиц N дисперсной фазы в единице объема V:
n = N/V.
При подстановке в формулу Вант-Гоффа получают выражение закона Вант-Гоффа для расчета осмотического давления дисперсных систем:
П = nkBT.
ð Осмотическое давление дисперсных систем пропорционально частичной концентрации сν дисперсной фазы (числу частиц в единице объема).
Число частиц N дисперсной фазы N = m / mч, где m – масса дисперсной фазы в данном объеме V; mч – средняя масса частиц дисперсной фазы.
=> Частичную концентрацию (число частиц в единице объема) можно определить как отношение массы дисперсной фазы m, находящейся в объеме системы V, к массе коллоидной частицы mч : n = m / m V.
=> n = сm / m,
где сm – массовая концентрация вещества дисперсной фазы (кг/м3).
Подставляя это значение сν в закон Вант-Гоффа, получаем:
П = (сm / mч )∙ kB Т.
Принимая, что коллоидная частица имеет шаровидную форму с радиусом r, получаем:
mч = 4 / 3πr3ρ ,
где ρ – плотность дисперсной фазы.
Тогда закон Вант-Гоффа можно преобразовать к виду:
П = 3mkBТ / 4πVr3ρ.
Из-за большого размера частиц дф и малых значений частичной концентрации осмотическое давление дисперсных систем приблизительно в 1000 раз меньше осмотического давле ния истинного раствора такой же массовой доли.
Течение дисперсных систем. Свободнодисперсные системы с жидкой и газовой дисперсионной средой (золи, суспензии, эмульсии, пены, аэрозоли) характеризуются большой подвижностью.
Под действием внешних воздействий: гидростатического давления, электрического напряжения – возникает течение жидкости или газа, которое увлекает находящиеся в них дисперсные частицы. Т.о. происходит перемещение всей дисперсной системы. Основная проблема заключается в учете влияния размера, формы и концентрации дч на скорость течения.
В свободнодисперсных системах основную роль играют гидродинамические эффекты, возникающие при взаимодействии частиц с жидкостью или газом. При большой концентрации частицы начинают контактировать между собой. Возникающая структура значительно уменьшает текучесть дисперсионной среды и течение может полностью прекратиться.
Рассмотрим следующую задачу: по трубке длиной l достаточно большого диаметра d = 2r (несколько см или больше) под действием перепада давления на ее концах (Δр) течет коллоидный раствор (золь) – взвесь твердых частиц в жидкости. Для упрощения будем рассматривать монодисперсную систему, т.е. все дисперсные частицы имеют одинаковый размер. Также примем, что все частицы имеют сферическую форму, а концентрация частиц ν мала, поэтому они находятся далеко друг от друга и не контактируют между собой.
При отсутствии дч, т.е. при течении однородной жидкости вязкостью η, средняя скорость ламинарного течения (v) определяется законом Пуазейля:
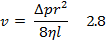
При таком же перепаде давления Δр течение дисперсной системы (коллоидного раствора) происходит с меньшей скоростью. А.Эйнштейн объяснил это тем, что присутствие дч приводит к возрастанию вязкости дисперсной системы (η*) по сравнению с вязкостью жидкости η, т.е. η* > η. Теория Эйнштейна определяет вязкость дс следующим уравнением:
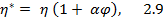
где φ – объемная доля дисперсной фазы; a – безразмерный коэффициент, который зависит от формы дч.
Для сферических частиц a = 2,5; для анизодиаметрических частиц (эллипсоидов, стержней и т.д.) a имеет более высокое значение. Чем больше вытянутость частицы, тем больше коэффициент a.
В соответствии с (2.9) вязкость коллоидной системы зависит от общего количества дч (от объемной доли дисперсной фазы), но не зависит от размера частиц.
Уравнение Эйнштейна можно преобразовать к форме:
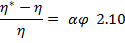
Дробь слева характеризует относительное увеличение вязкости дс при введении в нее дф; оно растет линейно при увеличении объемной доли дф.
Уравнение (2.10) позволяет по экспериментальной зависимости η* = f(φ)определить коэффициент a, зависящий от формы частиц. Эти данные в свою очередь используют для оценки размера дч и макромолекул.
| <== предыдущая страница | | | следующая страница ==> |
| Методы очистки дисперсных систем | | | Оптические свойства дисперсных систем |
Дата добавления: 2014-04-28; просмотров: 1026; Нарушение авторских прав

Мы поможем в написании ваших работ!