
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Лекция № 6 Осадительное титрование
Метод титриметрического анализа, основанный на применении титрантов, образующих с анализируемым веществом малорастворимые соединения.
Пример: Ag+ + I- → AgI↓
2I- + Mg2(NO3)2 → Mg2I2↓ + 2NO3-
3Zn2+ + 2K4[Fe(CN)6] → K2Zn3[Fe(CN)6]2 + 6K+
Растворимость и произведение растворимости
Ионные равновесия, связанные с осаждением и образованием осадков, являются обратимыми, подчиняются закону действия масс и характеризуются константой равновесия, так называемым произведением растворимости (ПР).
ПР – постоянная величина (Т, р, растворитель), равная произведению активных концентраций ионов в степенях их стехиометрических коэффициентах в насыщенном растворе малорастворимого электролита.
В общем виде для малорастворимого электролита:
MmAa ↔ mM + aA
ПРMmAa=[M]m ∙ [A]a
[M], [A]-равновесные концентрации ионов, моль/л.
Величины ПР даны в справочных таблицах.
1 следствие: если концентрация одного из ионов, входящих в произведение растворимости уменьшается, то концентрация другого увеличивается и наоборот.
2 следствие: если ПРMmAa > [M]m ∙ [A]a, то осадок будет растворятся,
ПРMmAa < [M]m ∙ [A]a, выпадение осадка.
Для сравнения растворимости осадков пользуются не величинами ПР, а растворимостью.
Растворимость (S) –общая концентрация вещества в его насыщенном растворе, складывается из концентрации всех форм вещества, в котором оно присутствует в растворе и связано с ПР следующим соотношением:
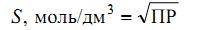
Для малорастворимого соединения:
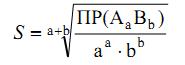
Факторы, влияющие на растворимость
1.влияние одноименного иона (эффект одноименного иона): при увеличении концентрации одноименного иона, S уменьшается (и наоборот).
2.влияние конкурирующих (побочных) реакций: учитывается с помощью aМе=См/[M]-коэффициент побочной реакции комплексообразования и aМе=СА/[А]- коэффициент побочной реакции протонирования.
3.влияние ионной силы раствора (солевой эффект)
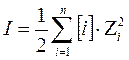 ,
,
где [i]-равновесная молярная концентрация i-го иона, zi-заряд иона. С увеличением ионной силы раствора, растворимость увеличивается.
4.температура:
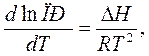
DН – тепловой эффект реакции, кДж/моль. При протекании экзотермических реакций (DН>0) растворимость с ростом температуры увеличивается, а при протекании эндотермических – уменьшается.
5.влияние природы растворителя: растворитель и растворяемое вещество должны быть одной хим.природы (неорганические вещества лучше растворяются в воде, а органические в органических растворителях.)
| <== предыдущая страница | | | следующая страница ==> |
| Дихроматометрия | | | Классификация методов осадительного титрования |
Дата добавления: 2014-04-30; просмотров: 481; Нарушение авторских прав

Мы поможем в написании ваших работ!