
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Решение. Молярные концентрации кислоты и соли в буферном растворе равны
|
Читайте также: |
Молярные концентрации кислоты и соли в буферном растворе равны:
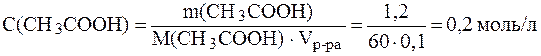 ;
;
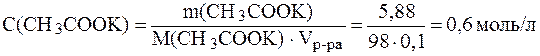 .
.
Подставив эти значения в уравнение (7), получим:
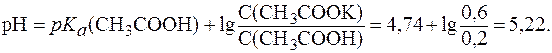
2. Рассчитать рН буферной смеси, если для ее приготовления были взяты растворы муравьиной кислоты и формиата натрия одинаковой молярной концентрации в соотношении 7:3. 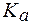 (НСООН) = 1,8×10-4.
(НСООН) = 1,8×10-4.
Решение.
Так как молярные концентрации кислоты и соли равны, то при расчете pH по формуле (5) можно использовать только объемное соотношение компонентов:
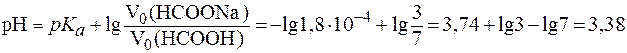 .
.
3. Рассчитать значение pH буферного раствора, полученного при сливании 20 мл раствора аммиачной воды с С(NH3·H2O) = 0,02 моль/л и 10 мл раствора хлорида аммония с С(NH4Cl) = 0,01 моль/л. 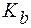 (NH3·H2O) = 1,8·10−5. Найти рН буфера, разбавленного в 5 раз.
(NH3·H2O) = 1,8·10−5. Найти рН буфера, разбавленного в 5 раз.
Решение.
В случае буферной системы II типа pH раствора рассчитывают по уравнению (6¢):
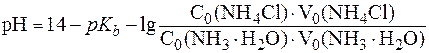 .
.
Подставив соответствующие значения, получим:
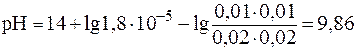 .
.
При разбавлении рН буферных растворов не изменяется. Следовательно, рН буферного раствора, разбавленного в 5 раз, будет равен 9,86.
4. Буферный раствор получен сливанием 100 мл раствора СН3СООН с С(СН3СООН) = 0,02 моль/л и 50 мл раствора CH3COONa с С(CH3COONa) = 0,01 моль/л. 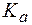 (СН3СООН) = 1,8×10-5. Рассчитать:
(СН3СООН) = 1,8×10-5. Рассчитать:
а) рН полученного буфера;
б) изменение рН буфера при добавлении 5 мл раствора HCl c C(HCl) = 0,01 моль/л.
в) буферную емкость раствора по щелочи.
| <== предыдущая страница | | | следующая страница ==> |
| Буферные системы слюны | | | Решение |
Дата добавления: 2014-09-10; просмотров: 739; Нарушение авторских прав

Мы поможем в написании ваших работ!