
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Решение
|
Читайте также: |
Для расчета рН полученного буфера воспользуемся формулой (5):
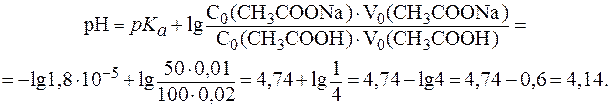
При добавлении кислоты протекает реакция:
СН3СОONa + HCl 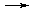 CH3COOH + NaCl,
CH3COOH + NaCl,
в результате которой изменяются количества компонентов буферной системы.
С учетом соотношения n(x) = C(x)×V(x) уравнение (7) может быть представлено в виде:
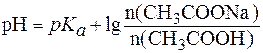 .
.
Так как количества прореагировавших и образовавшихся веществ равны, то изменение количеств кислоты и соли в буферном растворе составит одну и туже величину x:
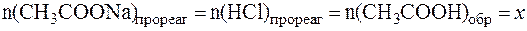 ,
,
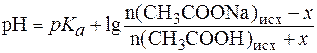 .
.
В исходной буферной смеси количества компонентов составляют:
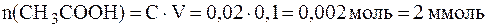 ;
;
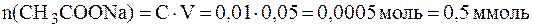 .
.
Найдем величину x:
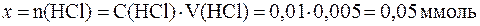 .
.
Отсюда:
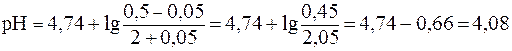 .
.
Таким образом, разность значений рН составит 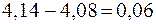 , т.е. изменение рН пренебрежимо мало.
, т.е. изменение рН пренебрежимо мало.
Буферная емкость раствора по щелочи определяется количеством эквивалента щелочи n(  x) (для однокислотного основания - n(x)), добавление которого к 1 л раствора увеличивает pH раствора на 1 единицу.
x) (для однокислотного основания - n(x)), добавление которого к 1 л раствора увеличивает pH раствора на 1 единицу.
Если использовать NaOH, то уравнение (7) примет вид:
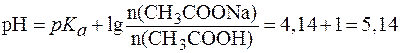 .
.
При добавлении щелочи протекает реакция:
СН3СОOH + NaOH  CH3COONa + H2O,
CH3COONa + H2O,
в результате которой изменяется количество компонентов буферного раствора:
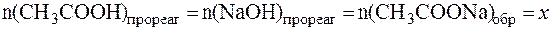
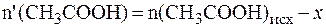 ;
;
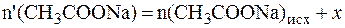 ,
,
где x - количество NaOH.
Отсюда:
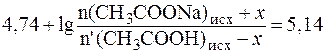 ;
;
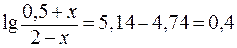 ;
;
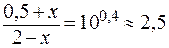 .
.
Решая полученное уравнение, получим: x » 1,3 ммоль.
Подставляя значения n(NaOH) = 1,3 ммоль, V(буфера) = 0,15 л и DpH = 1 в уравнение (9), получим:
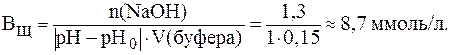
5. Рассчитать, объемы растворов Na2HPO4 и NaH2PO4 одинаковой молярной концентрации, которые необходимо взять для приготовле-ния 300 мл буферного раствора с pH = 7,5. Для фосфорной кислоты: 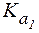 = 7,6×10-3;
= 7,6×10-3; 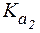 = 6,2×10-8,
= 6,2×10-8, 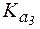 = 3,3×10-13.
= 3,3×10-13.
Решение.
В фосфатном буферном растворе протолитическое равновесие имеет вид:
H2PO4– ⇄ HPO42- + H+,
поэтому с учетом равных концентраций компонентов уравнение (5) запишется:
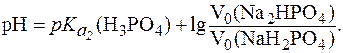
Подставляя значения pH и 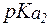 , получим:
, получим:
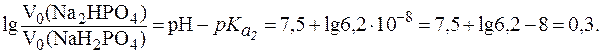
Отсюда:
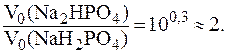
Решая систему уравнений:
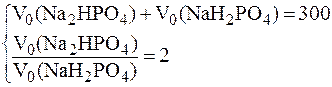
получим: V0(Na2HPO4) = 200 мл и V0(NaH2PO4) = 100 мл.
6. Найти объем раствора ацетата натрия с С(CH3COONa) = 0,04 моль/л, который надо добавить к 500 мл раствора уксусной кислоты с С(CH3COOH) = 0,1 моль/л, чтобы получить буферный раствор с рН = 3,74, если 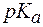 (СН3СООН) = 4,74.
(СН3СООН) = 4,74.
Решение.
Используя уравнение (7), получим:
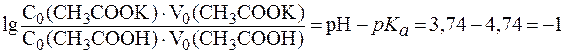 .
.
Отсюда:
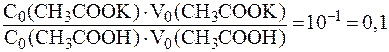 ;
;
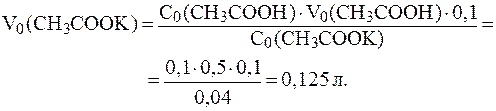
7. Найти массу гидрофосфата калия, которую надо добавить к 1500 мл раствора дигидрофосфата калия с С(KH2PО4) = 0,4 моль/л, чтобы приготовить буферный раствор c рН = 6,5. 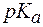 (H2PO4-) = 7,2.
(H2PO4-) = 7,2.
Решение.
В данном случае формула (5) принимает вид:
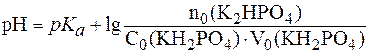 .
.
Отсюда:
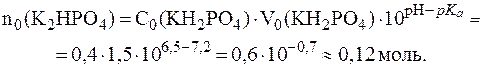
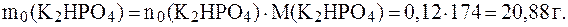
8. Буферный раствор приготовили смешиванием 50 мл раствора уксусной кислоты с концентрацией 0,1 моль/л и 80 мл раствора гидроксида калия с концентрацией 0,05 моль/л. Определить рН полученного раствора, если 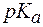 (СН3СООН) = 4,74.
(СН3СООН) = 4,74.
Решение.
В процессе приготовления раствора протекает реакция нейтрали-зации кислоты щелочью:
СН3СООН + КOH 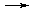 CH3COOК + H2O
CH3COOК + H2O
Количества взятых для реакции реагентов составляют:
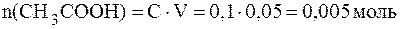 ;
;
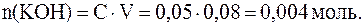
Количества прореагировавших между собой реагентов равны, поэтому количество оставшейся после реакции кислоты:
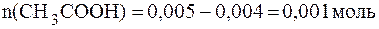 .
.
Количество образовавшейся соли равно количеству прореагиро-вавших реагентов и составляет 0,004 моль.
Используя уравнение (5), получаем:
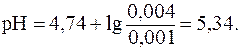
9. Найти объем раствора гидроксида калия с концентрацией 0,05 моль/л, который надо прилить к 50 мл раствора муравьиной кислоты с концентрацией 0,1 моль/л, чтобы получить буферный раствор с рН = 4. 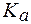 (НСООН) = 1,8∙10-4.
(НСООН) = 1,8∙10-4.
Решение.
Используя уравнение Гендерсона-Гассельбаха получаем:
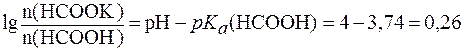 .
.
Следовательно:
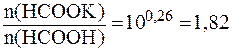 .
.
Количества взятых для реакции реагентов составляют:
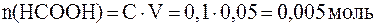 ;
;
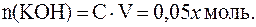
Количество прореагировавших реагентов равны между собой, поэтому количество оставшейся после реакции кислоты:
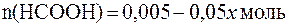 .
.
Количество образовавшейся соли равно количеству прореагиро-вавших реагентов и составляет 0,05х моль.
Таким образом:
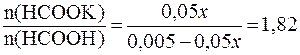 .
.
Решая уравнение, получаем:
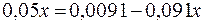 ;
;
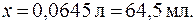
10. На титрование 50 мл буферного раствора с рН = 7,0 в присут-ствии индикатора HInd с 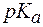 = 8,5 израсходовано 2 мл раствора NaOH с С(
= 8,5 израсходовано 2 мл раствора NaOH с С( 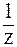 NaOH) = 0,8 моль/л. Вычислить буферную емкость раствора.
NaOH) = 0,8 моль/л. Вычислить буферную емкость раствора.
Решение.
В соответствии с теорией кислотно-основных индикаторов, в точке перехода окраски индикатора рН = 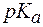 (HInd), т. е. после до-бавления NaOH рН = 8,5.
(HInd), т. е. после до-бавления NaOH рН = 8,5.
Тогда:
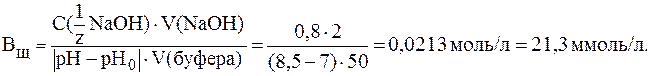
11. Буферная емкость гидрокарбонатной буферной системы по щелочи составляет 20 ммоль/л. Найти изменение pH буфера при добавлении к 100 мл буферного раствора 10 мл раствора KOH с С(KOH) = 0,1 моль/л.
Решение.
Изменение pH буфера найдем по формуле (9):
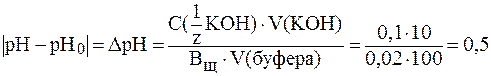 .
.
11. На титрование 50 мл фосфатного буфера, содержащего рав-ные количества Na2HPO4 и NaH2PO4, в присутствии индикатора HInd с 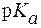 = 8,5 затрачено 2 мл раствора NaOH с С(NaOH) = 0,65 моль/л. Вычислить буферную емкость раствора, если
= 8,5 затрачено 2 мл раствора NaOH с С(NaOH) = 0,65 моль/л. Вычислить буферную емкость раствора, если 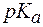 (H2PO4-) = 7,2.
(H2PO4-) = 7,2.
Решение.
Значение рН буфера до титрования найдем по уравнению Гендерсона-Гассельбаха. Поскольку количества компонентов равны:
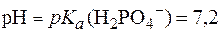 .
.
В соответствии с теорией кислотно-основных индикаторов, в точке перехода окраски индикатора рН = 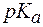 (HInd), т.е. после добавления NaOH рН = 8,5.
(HInd), т.е. после добавления NaOH рН = 8,5.
Тогда:
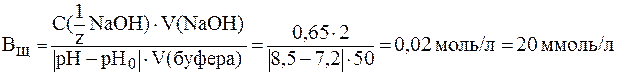 .
.
12. Рассчитать буферную емкость крови, если добавление к 50 мл крови 20 мл раствора HCl c C(HCl) = 0,05 моль/л вызвало снижение pH крови от 7,4 до 7,0.
Решение.
Буферную емкость крови по кислоте рассчитаем по формуле (8):
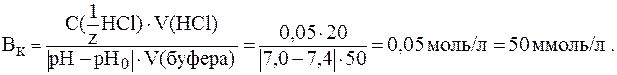
13. Определить, какие изменения произойдут в плазме крови человека, если парциальное давление СО2 над кровью увеличится на 10 мм рт. ст. по сравнению с нормой. Норме соответствуют значе-ния: pH = 7,4; С(НСО3-) = 24 ммоль/л; 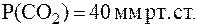 Физио-логическое значение
Физио-логическое значение 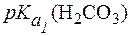 составляет 6,1.
составляет 6,1.
Решение.
Самая мощная буферная система крови - гидрокарбонатная. Она первой реагирует на изменения, происходящие в плазме крови и в эритроцитах. Таким образом, pH плазмы крови в указанных условиях можно рассчитать по уравнению (11):
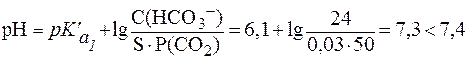 .
.
Незначительное снижение pH плазмы крови по сравнению с нормой свидетельствует о газовой (дыхательной) форме ацидоза.
14. Определить, какого типа буферная система находится в растворе валина, 1 л которого содержит 0,2 моль катионной формы и 0,4 моль биполярной формы. Рассчитать pH раствора, если для валина 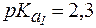 ,
, 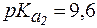 .
.
Решение.
В данном случае раствор валина представляет собой буферную систему I типа: катионная форма является слабой кислотой, а биполярный ион - сопряженным основанием. Равновесию между катионной и биполярной формами валина отвечает константа 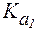 , поэтому уравнение Гендерсона-Гассельбаха имеет вид:
, поэтому уравнение Гендерсона-Гассельбаха имеет вид:
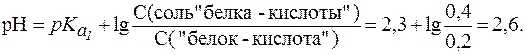
15. Определить, какого типа буферная система образуется при добавлении к 50 мл раствора аланина с молярной концентрацией 0,1 моль/л 20 мл раствора NaOH с С(NaOH) = 0,05 моль/л. Рассчитать рН раствора, если для аланина 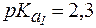 ,
, 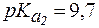 .
.
Решение.
В водном растворе аланин присутствует преимущественно в виде биполярного иона. При добавлении щелочи от группы -NH3+ биполярного иона аланина отщепляется протон и образуется форма «белок-основание»:
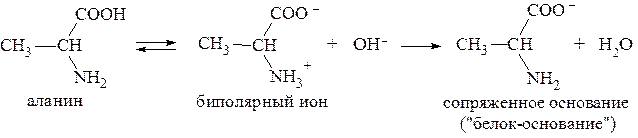
Таким образом, образуется буферная система II типа - слабое основание и его катион В/ВН+.
Количества взятых для реакции реагентов составляют:
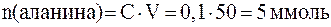 ;
;
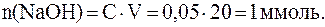
Количества прореагировавших между собой реагентов равны, поэтому количество аланина в форме биполярного иона (кислоты в уравнении Гендерсона-Гассельбаха) равно:
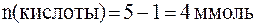 .
.
а количество сопряженного основания (формы «белок-основание»):
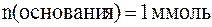 .
.
Равновесию соль «белка-основания»  «белок-основание» соот-ветствует константа
«белок-основание» соот-ветствует константа 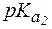 = 9,7, поэтому уравнение Гендерсона-Гассельбаха запишется:
= 9,7, поэтому уравнение Гендерсона-Гассельбаха запишется:
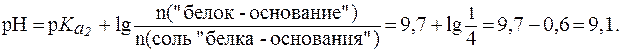
16. Найти соотношение форм глутамина при физиологических условиях (рН = 7,4), если для этой a-аминокислоты: 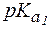 = 2,2;
= 2,2; 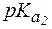 = 9,1. Проявляет ли в этих условиях раствор глутамина буферное действие?
= 9,1. Проявляет ли в этих условиях раствор глутамина буферное действие?
Решение.
Найдем величину pI глутамина:
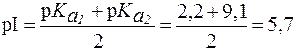 .
.
Так как pH > pI, то в растворе присутствуют анионная («белок-основание») и биполярная (соль «белка-основания») формы (буферная система II типа). Их соотношение определяется по уравнению Гендерсона-Гассельбаха:
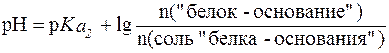
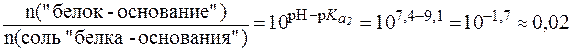 .
.
Таким образом, соотношение форм аминокислоты составляет 50:1. При таком соотношении количеств компонентов система буферного действия не проявляет.
Вопросы для самоконтроля
1. Что такое буферная система?
2. Что такое буферный раствор?
3. Что называется буферным действием?
4. Какие вам известны основные типы буферных систем? Приведите примеры.
5. Какие компоненты содержат буферные системы с точки зрения протолитической теории?
6. В чем заключается механизм действия буферных систем? Рассмотрите в качестве примеров ацетатную и аммонийную буферные системы.
7. Что называется буферной емкостью? От каких факторов зависит буферная емкость?
8. Как определяют величины буферной емкости по кислоте ( 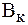 ) и по щелочи (
) и по щелочи ( 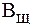 )? Для известных вам буферных систем укажите компонент, определяющий буферную емкость раствора по кислоте (по щелочи).
)? Для известных вам буферных систем укажите компонент, определяющий буферную емкость раствора по кислоте (по щелочи).
9. Запишите уравнение Гендерсона-Гассельбаха в общем виде, а также для ацетатной, гидрокарбонатной, фосфатной и аммиачной буферных систем.
10. От чего зависит величина рН буферных растворов?
11. Что такое зона буферного действия? Как она определяется?
12. Какие буферные системы поддерживают постоянство кислотно-основного равновесия плазмы крови? Какова их буферная емкость по кислоте и по щелочи?
13. Какие буферные системы поддерживают постоянство кислотно-основного равновесия внутри эритроцитов? Какова их буферная емкость по кислоте и по щелочи?
14. Что такое алкалоз и ацидоз? Как можно ликвидировать газовую и метаболическую формы ацидоза?
15. Какие количественные показатели характеризуют буферные свойства крови?
16. К 10 мл ацетатного буфера с рН = 6 добавили 90 мл воды. Чему равен рН раствора после разбавления? Изменилась ли буферная емкость системы после добавления воды?
17. Ацетатные буферные системы получены смешиванием:
1) 1 мл раствора кислоты с С(к-ты) = 0,1 моль/л и 9 мл раствора соли с С(соли) = 0,1 моль/л;
2) 1 мл раствора кислоты с С(к-ты) = 0,01 моль/л и 9 мл раствора соли с С(соли) = 0,01 моль/л.
Будет ли отличаться окраска растворов при добавлении индика-тора метилрот?
18. Для приготовления буферных растворов использовали:
1) 7 мл раствора NН3·Н2О с С(NH3·Н2О) = 0,2 моль/л и 3 мл раствора NН4С1 с С(NH4Cl) = 0,2 моль/л);
2) 5 мл раствора NН3·Н2О с С(NН3·Н2О) = 0,2 моль/л и 5 мл раствора NH4C1 с С(NH4Cl) = 0,2 моль/л.
Какой из приготовленных растворов имеет большую буферную емкость?
19. Можно ли приготовить буферную смесь:
1) аммиачную с рН = 7; 9; 11, если 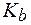 (NH3·H2O) = 1,8·10-5;
(NH3·H2O) = 1,8·10-5;
2) ацетатную с рН = 2; 4; 8, если 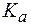 (СН3СООН) = 1,8·10-5;
(СН3СООН) = 1,8·10-5;
3) гидрокарбонатную с рН = 5; 7; 9, если 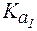 (Н2СО3) = 4,5·10-7;
(Н2СО3) = 4,5·10-7;
4) фосфатную буферную смесь с рН = 1; 4; 7, если 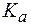 (H2PO4-) = 6,3·10-8.
(H2PO4-) = 6,3·10-8.
20. Исходные растворы компонентов аммиачной буферной системы одинаковой молярной концентрации смешаны в следующих соотношениях:
| Состав буферной системы | Объемные соотношения компонентов буферной системы | ||
| раствор I | раствор II | раствор III | |
| NH3∙H2O | |||
| NH4Cl |
Не прибегая к расчетам, определить, в каком из трёх буферных растворов будет наблюдаться:
1) наибольшее значение рН;
2) максимальная буферная емкость;
3) наибольшая буферная емкость по щелочи.
Варианты задач для самостоятельного решения
Вариант № 1
1. Фосфатный буфер приготовили, смешав 20 мл раствора NaH2PO4 с С(NaH2PO4) = 0,01 моль/л и 30 мл раствора Na2HPO4 с С(Na2HPO4) = 0,03 моль/л. Рассчитать рН полученного раствора, если 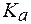 (Н2РО4-) = 6,3∙10-8.
(Н2РО4-) = 6,3∙10-8.
2. Определить, в каком объемном соотношении следует смешать растворы аммиачной воды и хлорида аммония одинаковой молярной концентрации, чтобы получить буферный раствор с рН = 10, если 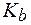 (NH3·H2O) = 1,85·10-5.
(NH3·H2O) = 1,85·10-5.
3. На титрование 20 мл буферного раствора с рН = 7 в присут-ствии индикатора HInd ( 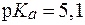 ) было затрачено 10 мл раствора кислоты с С(HCl) = 0,02 моль/л. Рассчитать буферную емкость раствора по кислоте.
) было затрачено 10 мл раствора кислоты с С(HCl) = 0,02 моль/л. Рассчитать буферную емкость раствора по кислоте.
4. Определить, какого типа буферная система находится в растворе глицина, 1 л которого содержит 0,3 моль катионной формы и 0,15 моль биполярной формы. Рассчитать pH раствора, если для глицина 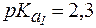 ,
, 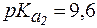 .
.
Вариант №2
1. Рассчитать pH аммиачного буфера, полученного при сливании 50 мл раствора аммиака с С(NН3·H2O) = 0,01 моль/л и 25 мл раствора NН4Cl с С(NН4Cl) = 0,015 моль/л, если 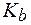 (NH3·H2O) = 1,85·10-5.
(NH3·H2O) = 1,85·10-5.
2. Определить, в каком объемном соотношении следует смешать растворы уксусной кислоты с С(СН3СООН) = 0,05 моль/л и ацетата натрия с С(CH3COONa) = 0,1 моль/л, чтобы получить буферную смесь с рН = 5. 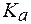 (СН3СООН) = 1,85∙10-5.
(СН3СООН) = 1,85∙10-5.
3. На титрование 20 мл фосфатного буфера, содержащего компо-ненты в равных концентрациях, в присутствии HInd c 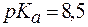 было израсходовано 30 мл раствора щелочи с С(КОН) = 0,01 моль/л. Вычислить буферную емкость раствора, если
было израсходовано 30 мл раствора щелочи с С(КОН) = 0,01 моль/л. Вычислить буферную емкость раствора, если 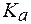 (Н2РО4-) = 6,3∙10-8.
(Н2РО4-) = 6,3∙10-8.
4. Определить, какого типа буферная система образуется при добавлении к 100 мл раствора лейцина с молярной концентрацией 0,1 моль/л 5 мл раствора KOH с С(KOH) = 0,5 моль/л. Рассчитать рН раствора, если для лейцина 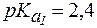 ,
, 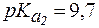 .
.
Вариант №3
1. Рассчитать рН ацетатного буфера, полученного при сливании 40 мл CH3COONa с С(CH3COONa) = 0,02 моль/л и 10 мл СН3СООН с С(СН3СООН) = 0,01 моль/л. 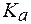 (СН3СООН) = 1,85×10-5.
(СН3СООН) = 1,85×10-5.
2 Найти концентрацию раствора хлорида аммония, который надо добавить к равному объему раствора аммиака с концентрацией 0,1 моль/л, чтобы получить буфер с рН = 9. 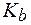 (NH3·H2O) = 1,85·10-5.
(NH3·H2O) = 1,85·10-5.
3. Рассчитать буферную емкость крови по щелочи, если при добавлении 1 мл раствора щелочи с С(KOH) = 0,05 моль/л к 100 мл крови рН крови возрастает от 7,36 до 7,6.
4. Найти соотношение форм серина при рН = 8,5, если для этой a-аминокислоты: 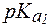 = 2,2;
= 2,2; 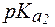 = 9,2. Проявляет ли в этих условиях раствор серина буферное действие?
= 9,2. Проявляет ли в этих условиях раствор серина буферное действие?
Вариант №4
1. Вычислить рН буферного раствора, в котором содержится 5,72 г NaH2PO4 и 11,36 г Na2HPO4. 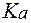 (Н2РО4-) = 6,3×10-8.
(Н2РО4-) = 6,3×10-8.
2. Необходимо приготовить буферный раствор с рН = 5,3. В лабо-ратории имеются растворы кислот: уксусной ( 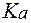 = 1,85∙10-5), бензойной (
= 1,85∙10-5), бензойной ( 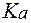 = 6,6∙10-5) и муравьиной (
= 6,6∙10-5) и муравьиной ( 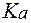 = 1,77∙10-4) одинаковой концентрации, которая равна 0,01 моль/л. Какую кислоту следует взять для приготовления буфера? Найти объем раствора гидроксида калия с концентрацией 0,05 моль/л, который необходимо прилить к 100 мл раствора кислоты, чтобы получить требуемый буфер.
= 1,77∙10-4) одинаковой концентрации, которая равна 0,01 моль/л. Какую кислоту следует взять для приготовления буфера? Найти объем раствора гидроксида калия с концентрацией 0,05 моль/л, который необходимо прилить к 100 мл раствора кислоты, чтобы получить требуемый буфер.
3. На титрование 10 мл ацетатного буфера с рН = 5 в присутствии фенолфталеина ( 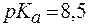 ) израсходовано 15 мл раствора щелочи с С(KOH) = 0,01 моль/л. Рассчитать буферную емкость раствора по щелочи.
) израсходовано 15 мл раствора щелочи с С(KOH) = 0,01 моль/л. Рассчитать буферную емкость раствора по щелочи.
4. Определить, какого типа буферная система находится в растворе треонина, 1 л которого содержит 0,75 моль анионной формы и 0,25 моль биполярной формы. Рассчитать pH раствора, если для треонина 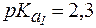 ,
, 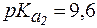 .
.
Вариант №5
1. Вычислить рН буфера, полученного при сливании 10 мл раствора NaH2PO4 с С(NaH2PO4) = 0,01 моль/л и 20 мл раствора Na2HPO4 с С(Na2HPO4) = 0,02 моль/л. 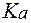 (Н2РО4-) = 6,3×10-8.
(Н2РО4-) = 6,3×10-8.
2. Найти объем раствора гидроксида натрия с С(NaOH) = 0,01 моль/л, который надо добавить к 200 мл раствора муравьиной кислоты с С(HCOOH) = 0,05 моль/л, чтобы получить буферный раствор с рН = 4. 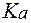 (НСООН) = 1,77∙10-4.
(НСООН) = 1,77∙10-4.
3. Буферная емкость крови по кислоте составляет 50 ммоль/л. Вычислить значение рН крови, если к 100 мл крови с рН = 7,36 добавлено 3,6 мл раствора соляной кислоты с С(HCl) = 0,05 моль/л.
4. Определить, какого типа буферная система образуется при добавлении к 100 мл раствора глутамина с молярной концентрацией 0,1 моль/л 10 мл раствора HCl с С(HCl) = 0,5 моль/л. Рассчитать рН раствора, если для глутамина 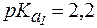 ,
, 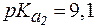 .
.
Вариант №6
1. Вычислить рН аммиачного буфера, полученного смешением 20 мл раствора аммиака с (NH3·Н2О) = 0,05 моль/л и 80 мл раствора хлорида аммония с С(NН4Cl) = 0,02 моль/л. 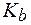 (NH3·Н2О) = 1,85×10-5.
(NH3·Н2О) = 1,85×10-5.
2. Найти объем раствора KOH c C(KOH) = 0,1 моль/л, который надо добавить к 100 мл 0,05 моль/л раствора уксусной кислоты с С(CH3COOH) = 0,05 моль/л, чтобы получить буферный раствор с рН = 4,5. 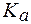 (СН3СООН) = 1,85×10-5.
(СН3СООН) = 1,85×10-5.
3. Определить объем буферного раствора c 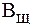 = 12,5 ммоль/л, использованного при титровании, если для увеличения его рН на две единицы потребовалось 0,05 л раствора KOH с С(КОН) = 0,1 моль/л.
= 12,5 ммоль/л, использованного при титровании, если для увеличения его рН на две единицы потребовалось 0,05 л раствора KOH с С(КОН) = 0,1 моль/л.
4. Найти соотношение форм аспарагина при рН = 2,5, если для этой a-аминокислоты: 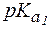 = 2,0;
= 2,0; 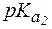 = 8,8. Проявляет ли в этих условиях раствор аспарагина буферное действие?
= 8,8. Проявляет ли в этих условиях раствор аспарагина буферное действие?
Вариант №7
1. Рассчитать, в каком объемном соотношении следует смешать растворы Na2HPO4 и NaH2PO4 одинаковой молярной концентрации, чтобы получить буфер с рН = 8. 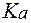 (Н2РО4-) = 6,3×10-8.
(Н2РО4-) = 6,3×10-8.
2. Необходимо приготовить буферный раствор с рН = 5. В лабо-ратории имеются растворы кислот: угольной ( 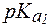 = 6,35), уксусной (
= 6,35), уксусной ( 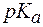 = 4,73) и муравьиной (
= 4,73) и муравьиной ( 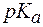 = 3,75) одинаковой концентрации, которая равна 0,01 моль/л. Какую кислоту следует взять при приготовления буфера? Найти объем раствора гидроксида натрия с С(NaOH) = 0,01 моль/л, который надо прилить к 100 мл раствора этой кислоты с концентрацией 0,05 моль/л, чтобы получить буфер с требуемым значением рН.
= 3,75) одинаковой концентрации, которая равна 0,01 моль/л. Какую кислоту следует взять при приготовления буфера? Найти объем раствора гидроксида натрия с С(NaOH) = 0,01 моль/л, который надо прилить к 100 мл раствора этой кислоты с концентрацией 0,05 моль/л, чтобы получить буфер с требуемым значением рН.
3. Установлено, что при добавлении к 50 мл крови 0,5 мл раст-вора щелочи с С(NaOH) = 0,05 моль/л рН крови возрастает от 7,36 до 7,5. Рассчитать буферную емкость крови по щелочи (в ммоль/л).
4. Определить, какого типа буферная система находится в растворе изолейцина, 1 л которого содержит 0,25 моль катионной формы и 0,5 моль биполярной формы. Рассчитать pH раствора, если для изолейцина 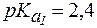 ,
, 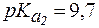 .
.
Вариант №8
1. Определить, какие изменения произойдут в плазме крови человека, если парциальное давление СО2 над кровью уменьшится на 10 мм рт. ст. по сравнению с нормой. Норме соответствуют значе-ния: pH = 7,4; С(НСО3-) = 26 ммоль/л; 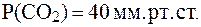 Физио-логическое значение
Физио-логическое значение 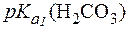 составляет 6,1.
составляет 6,1.
2. Найти объем раствора гидрофосфата калия с концентрацией 0,01 моль/л, который следует прилить к 50 мл раствора дигидро-фосфата калия с концентрацией 0,05 моль/л, чтобы получить буферный раствор с рН = 7. 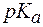 (Н2РО4-) = 7,2.
(Н2РО4-) = 7,2.
3. Вычислить буферную емкость ацетатного буфера, рН которого равен 5, если на титрование 15 мл этого буфера в присутствии фенолфталеина ( 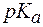 = 8,5) потребовалось 20 мл раствора щелочи с С(NaOH) = 0,02 моль/л.
= 8,5) потребовалось 20 мл раствора щелочи с С(NaOH) = 0,02 моль/л.
4. Определить, какого типа буферная система образуется при добавлении к 50 мл раствора метионина с молярной концентрацией 0,2 моль/л 4 мл раствора NaOH с С(NaOH) = 0,25 моль/л. Рассчитать рН раствора, если для метионина 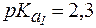 ,
, 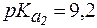 .
.
Вариант №9
1. Рассчитать рН аммиачного буфера, полученного добавлением к 100 мл раствора NH3 с концентрацией 0,05 моль/л 40 мл раствора HCl c концентрацией 0,04 моль/л. 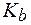 (NH3×Н2О) = 1,85×10-5.
(NH3×Н2О) = 1,85×10-5.
2. Определить объем раствора гидрофосфата калия с молярной концентрацией 0,06 моль/л, который следует добавить к 750 мл раст-вора дигидрофосфата калия с молярной концентрацией 0,075 моль/л, чтобы в системе установился рН = 6,2, если 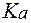 (H2PO4-) = 6,3·10-8.
(H2PO4-) = 6,3·10-8.
3. Определить, в каком соотношении были смешаны раствор уксусной кислоты с С(CH3COOH) = 0,05 моль/л и раствор ацетата калия с С(CH3COOK) = 0,1 моль/л, если на титрование 10 мл этого раствора в присутствии индикатора фенолфталеина ( 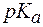 = 8,5) было затрачено 7 мл раствора щелочи с С(KOH) = 0,1 моль/л и буферная емкость составила 20 ммоль/л.
= 8,5) было затрачено 7 мл раствора щелочи с С(KOH) = 0,1 моль/л и буферная емкость составила 20 ммоль/л. 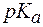 (СН3СООН) = 4,73.
(СН3СООН) = 4,73.
4. Найти соотношение форм пролина при рН = 10, если для этой a-аминокислоты: 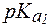 = 2,0;
= 2,0; 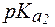 = 10,6. Проявляет ли в этих условиях раствор пролина буферное действие?
= 10,6. Проявляет ли в этих условиях раствор пролина буферное действие?
Вариант №10
1. Вычислить рН буферного раствора, в котором содержится 3,6 г уксусной кислоты и 8,2 г ацетата натрия. 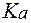 (СН3СООН) = 1,85×10-5.
(СН3СООН) = 1,85×10-5.
2. Рассчитать объем раствора хлорида аммония с С(NН4Cl) = 0,01 моль/л, который следует добавить к 400 мл раствора аммиачной воды с С(NH3·H2O) = 0,025 моль/л, чтобы рН полученного раствора стал равен 9,26. 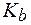 (NH3·H2O) = 1,8·10-5.
(NH3·H2O) = 1,8·10-5.
3. Найти объем раствора KOH c C(KOH) = 0,1 моль/л, который надо добавить к 6 л крови, чтобы увеличить ее рН на единицу. Буферную емкость крови по щелочи принять равной 15 ммоль/л.
4. Определить, какого типа буферная система находится в растворе триптофана, 1 л которого содержит 0,25 моль анионной формы и 0,75 моль биполярной формы. Рассчитать pH раствора, если для триптофана 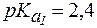 ,
, 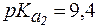 .
.
Вариант №11
1. Рассчитать рН буферного раствора, полученного добавлением к 50 мл раствора уксусной кислоты с С(СН3СООН) = 0,1 моль/л 30 мл раствора гидроксида калия c C(KOH) = 0,15 моль/л. 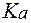 (СН3СООН) = 1,85×10-5.
(СН3СООН) = 1,85×10-5.
2. Определить, в каком объемном соотношении надо смешать растворы Na2HPO4 с концентрацией 0,05 моль/л и NaH2PО4 с концентрацией 0,1 моль/л, чтобы получить буфер с pH = 8, если 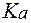 (Н2РО4-) = 6,3·10-8
(Н2РО4-) = 6,3·10-8
3. Найти объем раствора щелочи c C(KOH) = 0,1 моль/л, который надо добавить к 1 л формиатного буферного раствора, чтобы изме-нить его рН на 1, если на титрование 5 мл этого раствора с рН = 4 в присутствии индикатора фенофталеина ( 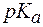 = 8,5) было затрачено 9 мл раствора щелочи c C(KOH) = 0,05 моль/л.
= 8,5) было затрачено 9 мл раствора щелочи c C(KOH) = 0,05 моль/л.
4. Определить, какого типа буферная система образуется при добавлении к 75 мл раствора фенилаланина с молярной концент-рацией 0,2 моль/л 30 мл раствора HCl с С(HCl) = 0,1 моль/л. Рассчитать рН раствора, если для фенилаланина 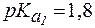 ,
, 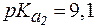 .
.
Вариант №12
1. Рассчитать, в каком объемном соотношении следует смешать растворы уксусной кислоты с концентрацией 0,1 моль/л и ацетата натрия с концентрацией 0,2 моль/л, чтобы получить буфер с рН = 4. 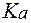 (СН3СООН) = 1,85×10-5.
(СН3СООН) = 1,85×10-5.
2. Вычислить парциальное давление CO2 (в кПа), которое необходимо создать над раствором, содержащим 12,2 г NaHCO3 в 1 л раствора, чтобы приготовить буферный раствор с pH = 6, если 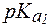 (H2CO3) = 6,36, S(CO2) = 0,033 ммоль/(л·мм рт. ст.).
(H2CO3) = 6,36, S(CO2) = 0,033 ммоль/(л·мм рт. ст.).
3. Найти объем раствора соляной кислоты с C(HCl) = 0,1 моль/л, который надо добавить к 5 л крови, чтобы изменить ее рН с 7,55 до 7,45. Буферную емкость крови по кислоте принять равной 50 ммоль/л.
4. Найти соотношение форм треонина при рН = 3, если для этой a-аминокислоты: 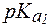 = 2,6;
= 2,6; 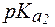 = 10,4. Проявляет ли в этих условиях раствор треонина буферное действие?
= 10,4. Проявляет ли в этих условиях раствор треонина буферное действие?
Вариант №13
1. Рассчитать рН аммиачного буфера, полученного смешением 60 мл раствора аммиака с С(NH3·Н2О) = 0,02 моль/л и 40 мл раствора NH4Cl с С(NH4Cl) = 0,01 моль/л. 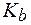 (NH3·Н2О) = 1,85·10-5.
(NH3·Н2О) = 1,85·10-5.
2. Определить, в каком объемном соотношении следует смешать растворы уксусной кислоты с концентрацией 0,1 моль/л и ацетата натрия с концентрацией 0,2 моль/л, чтобы получить буферную смесь с рН = 5, если 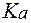 (СН3СООН) = 1,8·10-5.
(СН3СООН) = 1,8·10-5.
3. Фосфатный буфер приготовили, смешав равные объемы раствора NaH2PO4 c C(NaH2PO4) = 0,2 моль/л и раствора Na2HPO4 с C(Na2HPO4) = 0,1 моль/л. Найти буферную емкость этого раствора по кислоте, если на титрование 10 мл его с индикатором метиловым красным ( 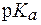 = 5,1) было затрачено 19,2 мл раствора соляной кислоты с C(HCl) = 0,05 моль/л.
= 5,1) было затрачено 19,2 мл раствора соляной кислоты с C(HCl) = 0,05 моль/л. 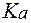 (Н2РО4-) = 6,3×10-8.
(Н2РО4-) = 6,3×10-8.
4. Определить, какого типа буферная система находится в растворе аланина, 1 л которого содержит 0,02 моль катионной формы и 0,1 моль биполярной формы. Рассчитать pH раствора, если для аланина: 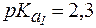 ,
, 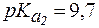 .
.
Вариант №14
1. Найти массу хлорида аммония, которую надо добавить к 750 мл раствора аммиачной воды с С(NH3·Н2О) = 0,01 моль/л, чтобы получить буферный раствор с рН = 8,5, если 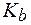 (NH3·H2O) = 1,8·10-5.
(NH3·H2O) = 1,8·10-5.
2. Определить, в каком объемном соотношении следует смешать растворы Na2HPO4 и NaH2PO4 одинаковой молярной концентрации, чтобы получить буферный раствор с рН = 7. 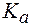 (Н2РО4-) = 6,3×10-8.
(Н2РО4-) = 6,3×10-8.
3. Буферная емкость ацетатного раствора по щелочи составляет 50 ммоль/л. Определить, в каком соотношении находятся в этом раст-воре уксусная кислота и ацетат натрия, если на титрование 10 мл этого раствора в присутствии индикатора фенолфталеина ( 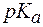 = 8,5) затрачено 15 мл раствора гидроксида калия с С(KOH) = 0,1 моль/л.
= 8,5) затрачено 15 мл раствора гидроксида калия с С(KOH) = 0,1 моль/л. 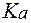 (СН3СООН) = 1,85∙10-5.
(СН3СООН) = 1,85∙10-5.
4. Определить, какого типа буферная система образуется при добавлении к 60 мл раствора серина с молярной концентрацией 0,1 моль/л 20 мл раствора KOH с С(KOH) = 0,05 моль/л. Рассчитать рН раствора, если для серина 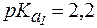 ,
, 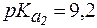 .
.
Вариант №15
1. Вычислить рН буферного раствора, полученного смешением 20 мл раствора NaH2PO4 с С(NaH2PO4) = 0,1 моль/л и 40 мл раствора Na2HPO4 с С(Na2HPO4) = 0,2 моль/л. 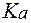 (Н2РО4-) = 6,3×10-8.
(Н2РО4-) = 6,3×10-8.
2. Найти массу ацетата натрия, которую надо добавить к 500 мл раствора уксусной кислоты с С(СН3СООН) = 0,01 моль/л, чтобы получить буферный раствор с рН = 5, если 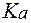 (СН3СООН) = 1,8·10-5.
(СН3СООН) = 1,8·10-5.
3. Найти объем раствора гидроксида калия с молярной концент-рацией 0,1 моль/л, который надо добавить к 50 мл буферного раст-вора, имеющего 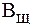 = 30 ммоль/л, чтобы увеличить его рН на 0,5.
= 30 ммоль/л, чтобы увеличить его рН на 0,5.
4. Найти соотношение форм фенилаланина при рН = 7, если для этой a-аминокислоты: 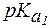 = 1,8;
= 1,8; 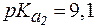 . Проявляет ли в этих условиях раствор фенилаланина буферное действие?
. Проявляет ли в этих условиях раствор фенилаланина буферное действие?
Вариант №16
1. Определить рН буферного раствора, полученного добавлением 30 мл раствора гидроксида калия с С(KOH) = 0,05 моль/л, к 20 мл с С(СН3СООН) = 0,2 моль/л. 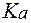 (СН3СООН) = 1,8·10-5.
(СН3СООН) = 1,8·10-5.
2. Найти массу гидрокарбоната натрия, которую надо добавить к 1500 мл раствора, парциальное давление CO2 над которым составляет 80 Па, чтобы получить буфер с рН = 7. 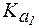 (Н2СО3) = 4,5·10−7, S(CO2) = 0,033 ммоль/(л·мм рт. ст.).
(Н2СО3) = 4,5·10−7, S(CO2) = 0,033 ммоль/(л·мм рт. ст.).
3. Рассчитать буферную емкость (в ммоль/л) крови по щелочи, если при добавлении к 50 мл крови 0,5 мл раствора гидроксида натрия с С(NaOH) = 0,05 моль/л рН крови увеличился от 7,36 до 7,5.
4. Определить, какого типа буферная система находится в растворе аспарагина, 1 л которого содержит 0,8 моль анионной формы и 0,5 моль биполярной формы. Рассчитать pH раствора, если для аспарагина 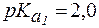 ,
, 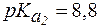 .
.
Вариант №17
1. Вычислить рН аммиачного буфера, полученного смешением 20 мл раствора аммиака и 80 мл раствора хлорида аммония, если растворы имели одинаковую молярную концентрацию. 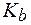 (NH3·Н2О) = 1,85×10-5.
(NH3·Н2О) = 1,85×10-5.
2. Вычислить объем раствора гидроксида калия с С(KOH) = 0,1 моль/л, который надо добавить к 50 мл раствора уксусной кислоты с С(СН3СООН) = 0,03 моль/л, чтобы образовался буферный раствор с рН = 5,2. 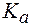 (СН3СООН) = 1,85∙10-5.
(СН3СООН) = 1,85∙10-5.
3. К 20 мл фосфатного буфера, имеющего буферную емкость по кислоте 35 ммоль/л, добавили 1 мл раствора азотной кислоты с С(HNO3) = 0,1 моль/л. Определить изменение рН раствора.
4. Определить, какого типа буферная система образуется при добавлении к 250 мл раствора глутамина с молярной концентрацией 0,04 моль/л 60 мл раствора HCl с С(HCl) = 0,1 моль/л. Рассчитать рН раствора, если для глутамина 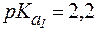 ,
, 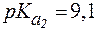 .
.
Вариант №18
1. Рассчитать рН ацетатного буфера, полученного путем сливания 20 мл раствора СН3СООН с С(СН3СООН) = 0,02 моль/л и 30 мл раствора CH3COONa с С(CH3COONa) = 0,01 моль/л, если 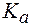 (СН3СООН) = 1,85×10-5.
(СН3СООН) = 1,85×10-5.
2. Определить объем раствора Na2HPO4 с концентрацией 0,03 моль/л, который нужно добавить к 450 мл раствора NaH2PО4 с концентрацией 0,015 моль/л, чтобы в системе установился рН = 6,2, если 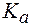 (Н2РО4-) = 6,3×10-8.
(Н2РО4-) = 6,3×10-8.
3. Буферная емкость аммиачного буфера по кислоте составляет 40 ммоль/л. Найти соотношение компонентов буферного раствора, если на титрование 5 мл этого буфера в присутствии индикатора метилового красного ( 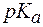 = 5,1) было затрачено 16 мл раствора соляной кислоты с C(HCl) = 0,05 моль/л.
= 5,1) было затрачено 16 мл раствора соляной кислоты с C(HCl) = 0,05 моль/л. 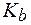 (NH3·H2O) = 1,8·10-5.
(NH3·H2O) = 1,8·10-5.
4. Найти соотношение форм изолейцина при рН = 10, если для этой a-аминокислоты: 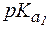 = 2,4;
= 2,4; 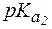 = 9,7. Проявляет ли в этих условиях раствор изолейцина буферное действие?
= 9,7. Проявляет ли в этих условиях раствор изолейцина буферное действие?
БЛОК ИНФОРМАЦИИ
ГЕТЕРОГЕННЫЕ РАВНОВЕСИЯ
Термодинамическую систему, все свойства которой во всех точ-ках одинаковы, либо плавно изменяются от точки к точке, называют гомогенной.
Гомогенная система может состоять из нескольких веществ, называемых компонентами. Гомогенными системами являются, например, водные растворы хорошо растворимых солей (NaCl, KCl, Ca(NO3)2) и органических соединений (этилового спирта, уксусной кислоты).
Термодинамическую систему, свойства которой от точки к точке изменяются скачкообразно, называют гетерогенной. Такая система состоит из нескольких гомогенных частей. Гомогенную часть гетеро-генной системы называют фазой. Каждая фаза характеризуется массой, геометрическими размерами, и, главное, наличием границы раздела, отделяющей ее от других фаз.
Гетерогенными системами являются, например, жидкость-пар, твердый осадок-насыщенный раствор, твердое тело-газ.
Следует отметить, что фазовый состав гетерогенной системы вовсе не предполагает различного агрегатного состояния составных частей системы. Так, например, гетерогенной является система вода-бензол. Обе фазы являются жидкими, но при этом в системе имеется граница раздела фаз, так как жидкости не смешиваются друг с другом.
Равновесия, которые устанавливаются на границе раздела фаз, называют гетерогенными равновесиями.
Гетерогенные равновесия играют существенную роль в жизне-деятельности организмов. Наиболее распространены гетерогенные равновесия, связанные с образованием твердой фазы малораст-воримых соединений, контактирующих с раствором. Формирование костной ткани, неорганическую основу которой составляет гидрокси-апатит, - наиболее типичный пример гетерогенного равновесия в живом организме.
В организме человека гетерогенные равновесия могут играть и негативную роль - под воздействием некоторых неблагоприятных факторов в реальных средах организма может начаться образование твердой фазы, свидетельствующее о патологии. Наиболее распро-страненными случаями являются, например, образование желчных камней, камней в мочевом пузыре, отложение уратов (солей мочевой кислоты) при подагре.
Исследование количественных изменений в организме, связан-ных с протеканием подобных процессов, может стать значительно эффективнее с привлечением теории гетерогенных равновесий в системе «осадок - насыщенный раствор» и правила произведения растворимости. Это позволит обоснованно принимать комплекс мер, предохраняющих от неблагоприятных внешних воздействий, а в случае патологии - корректировать процессы минерального обмена.
Произведение растворимости (ПР)
Рассмотрим процессы, возникающие при взаимодействии твердого вещества KtnAnm ионного типа с водой. Под действием растворителя ионы Ktm+ и Аnn- будут переходить в жидкую фазу и одновременно, за счет электростатического притяжения, часть пере-шедших в раствор ионов вновь будет осаждаться на твердой фазе. Спустя некоторое время в системе установится равновесие, кинети-ческим условием которого является равенство скоростей процессов растворения и осаждения, а термодинамическим - постоянство свободной энергии Гиббса (DG = 0).
Раствор, находящийся в равновесии с твердой фазой, называют насыщенным. Иными словами, насыщенный раствор - это раствор, в котором при данной температуре содержится максимально возможное количество растворенного вещества. Если количество растворенного вещества меньше максимально возможного, раствор называется ненасыщенным, если больше - пересыщенным.
Мерой растворимости вещества при данных условиях служит концентрация его насыщенного раствора. Поэтому численно раство-римость может быть выражена тем же способом, что и концентрация: например, в процентном содержании растворенного вещества в насы-щенном растворе или количеством растворенного вещества, содер-жащимся в 1 л насыщенного раствора.
Нередко используют понятие коэффициент растворимости, ко-торый выражается массой вещества, способной раствориться в 100 г растворителя при данной температуре.
Для малорастворимых соединений чаще всего используют молярную концентрацию насыщенного раствора, которую называют растворимостью вещества Р.
Растворимость твердых веществ зависит от природы растворенного вещества и растворителя, а также от состава раствора и температуры. Растворимость газов зависит, главным образом, от состава раствора и парциального давления.
Влияние природы компонентов раствора выражается простым правилом: подобное растворяется в подобном, т.е. растворенные вещества с ионными или сильно полярными ковалентными связями лучше растворяются в полярных растворителях (например, воде), а вещества с малополярными или неполярными связями - в неполяр-ных растворителях (например, гексане).
Растворимость твердых тел, как правило, увеличивается с повы-шением температуры и мало зависит от давления. Для газов характер-на противоположная зависимость: с ростом температуры их раство-римость уменьшается, а при повышении давления - увеличивается.
В водных растворах растворенная часть вещества-электролита, в большинстве случаев, полностью диссоциирует на ионы. Поэтому в системе твердое вещество – насыщенный раствор устанавливается равновесие между осадком и ионами, образовавшимися при диссоциации растворенной части вещества:
|
|
Применив к этому равновесию закон действующих масс, получим выражение для константы равновесия:
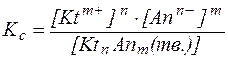 .
.
При постоянной температуре количество осадка в системе с течением времени не изменяется, и при данных условиях концен-трация твердой фазы является величиной постоянной. Соответст-венно, произведение константы равновесия на концентрацию твердой фазы также будет величиной постоянной:
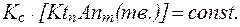
Следовательно:
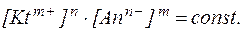
Таким образом:
В насыщенном растворе малорастворимого сильного электро-лита при данной температуре произведение молярных концентраций его ионов, возведенных в степени их стехиометрических коэффици-ентов, есть величина постоянная и называется произведением растворимости.
Произведение растворимости ПР (или 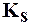 ) количественно харак-теризует растворимость данного вещества при данной температуре.
) количественно харак-теризует растворимость данного вещества при данной температуре.
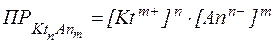 . .
| (1) |
В этой формуле m и n – число анионов и катионов в формуле вещества.
Величина ПР зависит от природы электролита, растворителя и температуры. С ростом температуры ПР обычно увеличивается, так как при нагревании раствора для большинства твердых веществ характерно увеличение растворимости. В медицинской практике наибольший интерес вызывают водные растворы электролитов, поэтому в рамках данной темы другие растворители использоваться не будут.
Пример 1. Написать выражения для ПP следующих солей: AgCl, BaSO4, PbCl2, Ca3(PO4)2.
Решение.
| AgCl ⇄ Ag+ + Cl- | 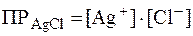
|
| BaSO4 ⇄ Ba2+ + SO42- | 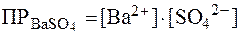
|
| PbCl2 ⇄ Pb2+ + 2Cl- | 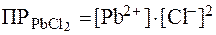
|
| Ca3(PO4)2 ⇄ 3Ca2+ + 2PO43- | 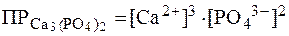
|
Приведенные уравнения, написанные на основе классической теории электролитической диссоциации, не вполне точны, так как в них не учтено влияние на растворимость электролита электростати-ческих сил, действующих между ионами. Если учесть это влияние, т. е. вместо концентраций Ktm+ и Аnn- в уравнение (1) подставить их активности в насыщенном растворе, то величина произведения растворимости несколько уменьшится.
Однако, в большинстве случаев, насыщенные растворы малораст-воримых электролитов являются очень разбавленными и их ионная сила близка к нулю (так, ионная сила насыщенного раствора BaSO4 имеет порядок 10-5). В таких случаях различия между концентрацией и активностью ионов можно не принимать во внимание.
К хорошо растворимым электролитам правило произведения рас-творимости неприменимо. Величину ПР можно использовать только в отношении электролитов, растворимость которых в воде не пре-вышает 0,01 моль/л. Численные значения произведения растворимо-сти различных малорастворимых электролитов указаны в таблице 1.
Поскольку растворенная часть сильного электролита полностью распадается на ионы по уравнению
KtnAnm  nKtm+ + mAnn-,
nKtm+ + mAnn-,
то при растворимости вещества Р концентрация катионов составит nР, а концентрация анионов - mР.
Тогда:
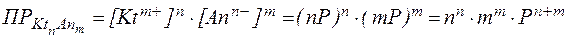
Следовательно:
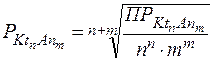 , ,
| (2) |
где n, m - стехиометрические коэффициенты т.е. число катионов и анионов).
Полученное выражение позволяет рассчитывать концентрацию насыщенного раствора вещества (растворимость) Р (в моль/л) по величине его произведения растворимости ПР.
В некоторых случаях растворимость выражают в г/л. Пересчет можно выполнить при помощи соотношения:
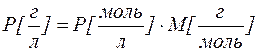
| (3) |
где M - молярная масса электролита.
Пример 2. Написать выражения, связывающие Р (моль/л) и ПP малорастворимых электролитов: AgI, CaF2, Al(OH)3 Mg3(PO4)2.
Решение.
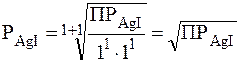 ;
;
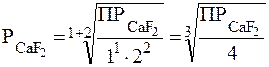 ;
;
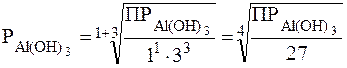 ;
;
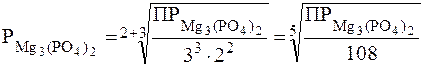 .
.
Пример 3. Определить, какая из солей является более раствори-мой: CaSO4 или BaCO3, если 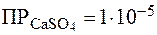 ,
, 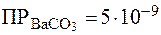 .
.
Решение.
Растворимость данных солей связана с ПР по одному и тому же уравнению: 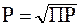 . В этом смысле соли являются однотипными и для сравнения их растворимости достаточно сопоставить величины их ПР. Очевидно, что
. В этом смысле соли являются однотипными и для сравнения их растворимости достаточно сопоставить величины их ПР. Очевидно, что 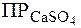 >
> 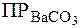 , следовательно, сульфат кальция более растворим.
, следовательно, сульфат кальция более растворим.
Пример 4. Сравнить растворимость солей: AgCl и Ag2CrO4, если 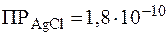 ,
, 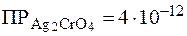 .
.
Решение.
В данном случае сравнение величин ПР недопустимо, так как соли неоднотипны. Действительно:
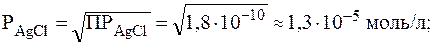
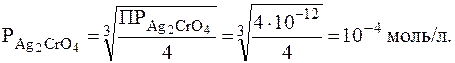
Таким образом, более растворимой солью является хромат серебра, тогда как сравнение величин ПР приводит к обратному заключению.
Таблица 1. Произведения растворимости некоторых малорастворимых солей и гидроксидов в водных растворах
| Вещество | ПР | Вещество | ПР | |||||
| AgCl | 1,8×10–10 | CuCN | 3,2×10–20 | |||||
| AgBr | 6,0×10–13 | Cu(OH)2 | 2,2×10–20 | |||||
| AgI | 1,1×10–16 | CuSO3 | 2,5×10–10 | |||||
| AgCN | 6,2×10–10 | CuS | 6,0×10–36 | |||||
| AgOCN | 2,3×10–7 | FeCO3 | 2,5×10–11 | |||||
| AgNO2 | 7,2×10–12 | FePO4 | 1,3×10–22 | |||||
| AgIO3 | 3,0×10–8 | FeS | 5,0×10–18 | |||||
| Ag2S | 6,0×10–50 | Hg2Cl2 | 1,3×10–18 | |||||
| Ag2CO3 | 8,2×10–12 | HgS | 4,0×10–53 | |||||
| Ag2SO4 | 2,0×10–5 | Li2CO3 | 2,0×10–3 | |||||
| Ag2CrO4 | 4,0×10–12 | LiF | 3,8×10–3 | |||||
| Ag2Cr2O7 | 2,0×10–7 | Mg(OH)2 | 6,0×10–10 | |||||
| Ag3PO4 | 1,0×10–20 | MgCO3 | 2,0×10–5 | |||||
| Ag3AsO3 | 1,0×10–22 | MgC2O4 | 8,6×10–5 | |||||
| Al(OH)3 | 1,0×10–32 | Mg3(PO4)2 | 1,0×10–23 | |||||
| AlPO4 | 5,7×10–19 | Mn(OH)2 | 2,0×10–13 | |||||
| BaCO3 | 5,1×10–9 | MnCO3 | 1,0×10–11 | |||||
| BaC2O4 | 1,1×10–7 | MnS | 2,5×10–10 | |||||
| BaCrO4 | 1,6×10–10 | Ni(OH)2 | 2,0×10–15 | |||||
| BaF2 | 1,7×10–6 | Pb(OH)2 | 1,1×10–20 | |||||
| Ba3(PO4)2 | 6,0×10–39 | PbF2 | 3,2×10–8 | |||||
| BaSO3 | 8,0×10–7 | PbCl2 | 2,0×10–5 | |||||
| BaSO4 | 1,1×10–10 | PbBr2 | 9,1×10–6 | |||||
| Ba(OH)2 | 5,0×10–3 | PbI2 | 8,0×10–9 | |||||
| Ca(OH)2 | 5,5×10–6 | PbCO3 | 7,5×10–14 | |||||
| CaCO3 | 5,0×10–9 | PbCrO4 | 1,8×10–14 | |||||
| CaC2O4 | 2,0×10–9 | PbS | 1,0×10–27 | |||||
| CaSO4 | 2,5×10–5 | PbSO4
Дата добавления: 2014-09-10; просмотров: 4010; Нарушение авторских прав 
Мы поможем в написании ваших работ! |