
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Протолитические реакции. Буферные растворы
Основные уравнения по теме:
«Протолитические реакции. Буферные растворы»
1. рKa = -lgKa - показатель константы кислотности
2. рKb =-lgKb - показатель константы основности
3. рH = -lg [H+] - водородный показатель среды
4. pOH = -lg [OH-] - гидроксильный показатель среды
5. [H+]×[OH-] = 1×10-14 - ионное произведение воды
pH + pOH = 14
6. 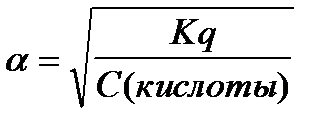 - закон разведения Оствальда
- закон разведения Оствальда
7. рH = 1/2 [pKa - lgC(1/z кислоты)] - расчет рН для растворов слабых кислот
8. pH = 14-1/2 [pKb - lgC(1/z основания)] - расчет рН для растворов слабых оснований
9. 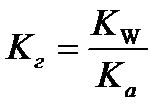 - расчёт константы гидролиза соли слабой кислоты и сильного основания
- расчёт константы гидролиза соли слабой кислоты и сильного основания
10. 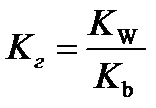 - расчёт константы гидролиза соли слабого основания и сильной кислоты
- расчёт константы гидролиза соли слабого основания и сильной кислоты
11. 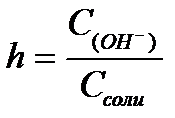 ,
, 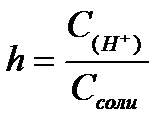 ,
, 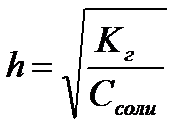 - степень гидролиза соли
- степень гидролиза соли
12. 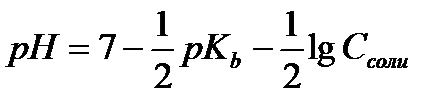 - расчёт рН раствора соли, гидролизующейся по катиону
- расчёт рН раствора соли, гидролизующейся по катиону
13. 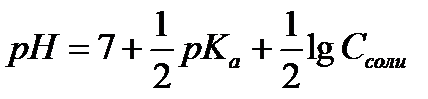 - расчёт рН раствора соли, гидролизующейся по аниону
- расчёт рН раствора соли, гидролизующейся по аниону
14. 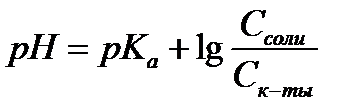 - расчет рН для буферных систем I типа
- расчет рН для буферных систем I типа
15. 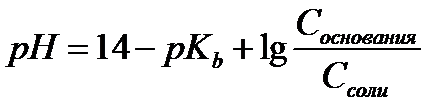 - расчет рН для буферных систем II типа
- расчет рН для буферных систем II типа
16. 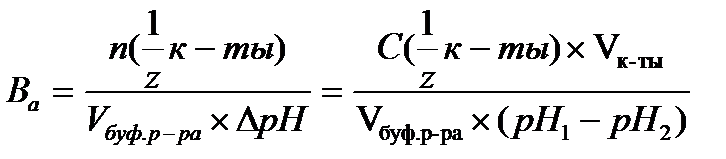 - определение буферной емкости по кислоте
- определение буферной емкости по кислоте
17. 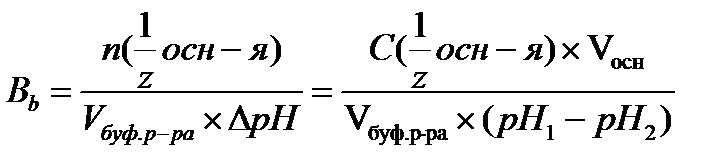 - определение буферной емкости по основанию
- определение буферной емкости по основанию
18. 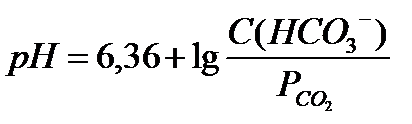 - уравнение Гендерсона-Гассельбаха для бикарбонатной буферной системы
- уравнение Гендерсона-Гассельбаха для бикарбонатной буферной системы
19. HHb + O2 + HCO3- = HbO2- + H2CO3 - суммарный процесс, протекающий в легочных капиллярах
20. HbO2- + H2CO3 = O2 + HHb + HCO3 - - суммарный процесс, протекающий в тканевых капиллярах
Обучающие задачи
Задача 1.Биологические жидкости имеют следующие значения рН: слюна 6,8; желудочный сок 1,5; кровь 7,4. Рассчитайте концентрацию ионов водорода в каждой из указанных жидкостей.
Решение: рН= - lg [H+] , lg [H+] = - pH
а) слюна рН = 6,8 , отсюда lg [H+] = -6,8
[H+]=10-6,8=1,59∙´10 -7 моль/л
б) желудочный сок рН = 1,5
рН= - lg [H+] , lg [H+] = - pH, отсюда lg [H+] = - 1,5
[H+]=10-1,5=3,16∙´10 -2 моль/л
в) кровь рН = 7,4
рН= - lg [H+] , lg [H+] = - pH
отсюда lg [H+] = -7,4
[H+]=10-7,4 = 4,0´10 -8 моль/л
Ответ: слюна [H+] = 1,59∙´10-7моль/л, желудочный сок [H+] = 3,16´10-2 моль/л, кровь [H+] = 4´10 -8 моль/л.
Задача 2. Вычислите степень диссоциации уксусной кислоты в растворе с молярной концентрацией эквивалента 0,001 моль/л. Ка (СН3СООН) = 1,8´10-5. Найти концентрацию ионов водорода и рН данного раствора.
Решение:
рН = 1/2 [pKa - lgC(CH3COOH)]; pH = 1/2 [4,75 - lg 0,001] = 1/2∙´ 7,75 = 3,875
[H+] = 10-pH = 10-3,875 = 1,35 ×10 -4;
[H+] = 1,35´10-4 моль/л.
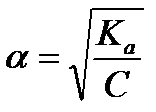 или
или 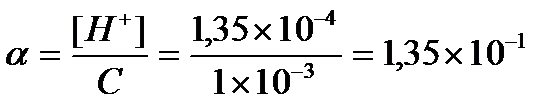 или 13,5%
или 13,5%
Ответ: [H+] = 1,35 ´10-4 моль/л, рН = 3,875, α = 13,5%.
Задача 3. В клинических и биохимических лабораториях применяется ацетатный буфер, который содержит уксусную кислоту 12 г/л и ацетат натрия 16,4 г/л. Определите концентрацию в моль/л уксусной кислоты и ацетата натрия, рН буферного раствора, зону буферного действия. (Ка (СН3СООН) = 1,8 ´10-5).
Решение:
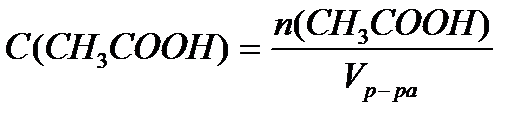
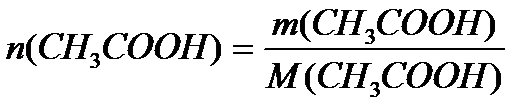
M (CH3COOH) = 12+3+12+32+1 = 60 г/моль
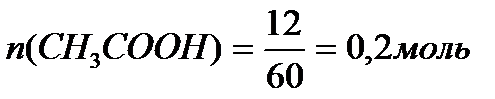
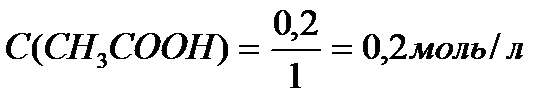
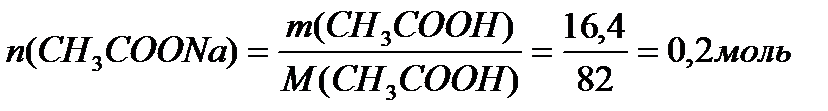
M (CH3COONa) = 12+3+12+32+23 = 82 г/моль.
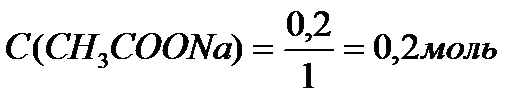
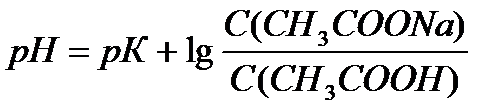
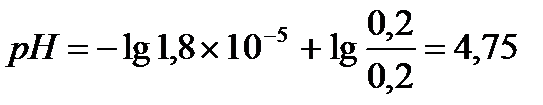
Ответ: С(CH3COOH)=0,2 моль/л, С(CH3COONa) =0,2 моль/л, pH = 4,75, зона буферного действия 4,75 ±1
Задача 4.Напишите уравнения гидролиза: CuCl2, Na2SO3, Cr2S3, NaCl, тристеарид, глицил-глицин, этилэтаноат, АТФ.
Решение:
CuCl2 – растворимая в воде соль, образована катионом слабого основания и анионом сильной кислоты, подвергается гидролизу. Гидролиз протекает по катиону слабого основания, рН<7.
При обычных условиях гидролиз протекает преимущественно по I ступени.
CuCl2 = Cu2+ + 2Cl-
Cu2+ +HOH ↔ CuOH+ + H+
CuCl2 + HOH ↔ CuOHCl + HCl
Na2SO3 – растворимая в воде соль, образована катионом сильного основания и анионом слабой кислоты, подвергается гидролизу. Гидролиз протекает по аниону слабой кислоты, рН>7.
Na2SO3 = 2Na+ + SO32-
SO32- + HOH ↔ HSO3- + OH-
Na2SO3 + HOH ↔ NaHSO3 + NaOH
Cr2S3– соль, образованная слабым нерастворимым в воде основанием и слабой летучей кислотой. В водном растворе соль не существует, так как подвергается полному гидролизу:
Cr2S3 + 6HOH = 2Cr(OH)3↓ + 3H2S↑
NaCl– растворимая в воде соль, образована катионом сильного основания и анионом сильной кислоты. Гидролизу не подвергается.
Тристеарид – это жир, образованный многоатомным спиртом глицерином и стеариновой кислотой, эти вещества и получаются при гидролизе:
CH2-O-CO-C17H35 CH2-OH
| |
CH-O-CO-C17H35 + 3H2O ↔ CH-OH + 3C17H35COOH
| |
CH2-O-CO-C17H35 CH2-OH
Глицилглицин– дипептид, при его гидролизе происходит разрыв пептидной связи
NH2-CH2-CO-NH-CH2-COOH + H2O ↔ NH2-CH2-COOH + NH2-CH2-COOH
Этилэтаноат – сложный эфир, при гидролизе которого образуются спирт и карбоновая кислота.
СH3COOC2H5 + HOH ↔ CH3COOH + C2H5OH
Аденозинтрифосфат (АТФ) – главный источник энергии для многих биологических процессов – биосинтеза белка, ионного транспорта, сокращения мышц, электрической активности нервных клеток. Гидролиз АТФ записывают в виде кислотно-основного равновесия:
АТФ4- + HOH ↔ АДФ3- + HPO42- + H+, ∆G0=-30,5кДж/моль
Задача 5.Определить рН раствора, константу и степень гидролиза ацетата калия, если молярная концентрация соли равна 0,1 моль/л, а Kа(СН3СООН)=1,8×10-5.
Решение:Уравнение гидролиза
СН3СООК + НОН ↔ СН3СООН + КОН
СН3СОО- + НОН ↔ СН3СООН + ОН-
Вычислим константу гидролиза
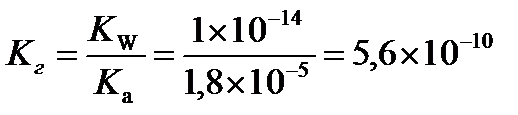
Рассчитаем степень гидролиза
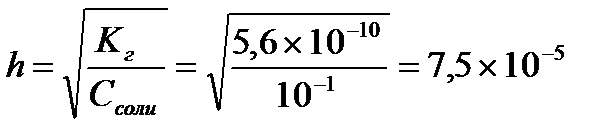
Определяем концентрацию гидроксид-ионов в растворе и рОН
С(ОН-)= h×Cсоли = 7,5×10-5×0,1 = 7,5×10-6 (моль/л)
рOН = -lg[OH-] = -lg7,5×10-6 = 5,12
pH = 14 – pOH = 14 – 5,12 = 8,88
Ответ:рН = 8,88, Кг = 5,6×10-10, h = 7,5×10-5
Задачи для самостоятельной работы
Задача 1. Вычислите степень диссоциации и рН уксусной кислоты, если Ка(СН3СООН)=1,8´10 -5, а концентрация 0,18 моль/л.
Ответ: рН = 2,74; α= 1 %.
Задача 2. Концентрация ионов [OH-] в растворе равна 6,5×10-8 моль/л. Вычислите рН этого раствора.
Ответ: рН=6,81
Задача 3. Во сколько раз концентрация ионов водорода в крови (рН=7,36) больше, чем в спинномозговой жидкости (рН=7,53)?
Ответ: в 1,5 раза
Задача 4. Определите концентрацию ионов водорода желчи в протоках, если её рН= 7,8 - 8,5.
Ответ:1,58´10-8 - 3,16´10-9
Задача 5.Вычислите соотношение С(соли)/С(кислоты) для буферной системы муравьиная кислота - формиат натрия, если рН = 4,0, Ка (НСООН) = 1,76´10 -4.
Ответ: 1,76
Задача 6.Определите рН буферного раствора, который получен смешиванием 0,1 моль/л раствора NH4Cl и 0,1 моль/л раствора NH4OH в соотношении: а) = 1:1, б) 1:4, в) 4:1. К (NH4OH) = 1,79´10 - 5
Ответ: а) рН = 9,26 , б) рН = 9,86, в) рН= 8,66.
Задача 7. Вычислите массу ацетата натрия, которою следует добавить к раствору уксусной кислоты С(СН3СООН) = 0,316 моль/л и объемом 2 л, чтобы получить буферный раствор с рН= 4,87.
Ответ: 68,4 г
Задача 8. Сколько молей эквивалента аскорбиновой кислоты необходимо ввести больному для нормализации крови при алкалозе, если рН его крови 7,65 (норма 7,45) общее количество крови 5л, буферная емкость по кислоте 0,05 моль/л.
Ответ: 0,05 моль - эквивалента.
Задача 9.? Буферная емкость по кислоте 0,05 моль/л, рассчитайте, какой объем хлороводородной кислоты концентрацией 0,1 моль/л необходимо добавить к 1л крови, чтобы уменьшить её рН с 7,35 до 7,1?
Ответ: 0,125 литра
Задача 10.Напишите по стадиям уравнения реакций гидролиза следующих солей: FeCl3, CuSO4. На основании чего можно утверждать, что последняя стадия реакции гидролиза этих солей не происходит.
Тестовые вопросы
1. Сокращенное молекулярно-ионное уравнение Ва+2+SO42-=BaSO4 соответствует реакции:
1) Ba(NO3)2+SO2® 2) BaCO3+H2SO4®
3) BaCl2+Na2SO4® 4) Ba3(PO4)2+H2SO4®
2. Полному гидролизу подвергаются соли___.
1) CrCl3 3) Cr2S3
2) Al2(SO4)3 4) Cs2CO3
3. Нейтральную среду имеют растворы солей ___.
1) RbNO3 2) HCOOK 3) BaCl2 4) CsF
4. Кислую среду имеют растворы солей___.
1) K2SiO3 2) AlCl3 3) (NH4)2SO4 4) CaCl2
5. Сильными электролитами являются ____.
1) HI 2) CuSO4 3) NH4OH 4) Ca3(PO4)2
6. Отношение числа молекул, диссоциирующих на ионы, к общему числу молекул растворенного вещества, называется _____ диссоциации.
1) коэффициентом 3) показателем
2) степенью 4) константой
7. В водном растворе гидролизу не подвергаются соли____.
1) K2SiO3 2) K2SO4 3) AlCl3 4) NaNO3
8. Среда водного раствора хлорида аммония____.
1) слабощелочная 3) нейтральная
2) кислая 4) сильнощелочная
9. Диссоциация по трем ступеням возможна в растворе________.
1) хлорида алюминия 3) фосфата калия
2) нитрата алюминия 4) ортофосфорной кислоты
10. Ионы I-образуются при диссоциации____.
1) KIO3 2) KI 3) C2H5I 4) NaIO4
11. Лакмус краснеет в растворе соли _____
1) FeSO4 2) KNO3 3) NaCI 4) Na2CO3
12. Вещество, при диссоциации которого образуются ионы Na+, H+, а также анионы SO42- является___.
1) кислотой 3) средней солью
2) щелочью 4) кислой солью
13. Кислую среду имеет водный раствор____.
1) карбоната натрия 3) иодида калия
2) нитрата калия 4) хлорида алюминия
14. Сокращенное ионное уравнение Fe2+ + 2OH- =Fe(OH)2 соответствует взаимодействию веществ:
1) Fe(NO)3 и KOH 3) Na2S и Fe(NO3)2
2) FeSO4 и LiOH 4) Ba(OH)2 и FeCI3
15. Сокращенное ионное уравнение Ba2+ + SO42-- = BaSO4 соответствует взаимодействию веществ: 1) BaCI2 и K2SO4 3) Ba(OH)2 и H2SO4
2) BaO и H2SO4 4) BaSO4 и FeCI3
16. Среда водного раствора сульфата алюминия_____.
1) щелочная 3) нейтральная
2) кислая 4) слабощелочная
17. Наиболее слабым электролитом является____.
1) HF 2) HCI 3) HBr 4) HI
18. В качестве анионов только ионы ОН- образуются при диссоциации___.
1) CH3OH 2) Zn(OH)Br 3) NaOH 4) CH3COOH
19. Щелочную и кислую реакцию среды соответственно имеют растворы солей____.
1) Na2CO3 и Ba(NO3)2 3) FeCI3 и ZnSO4
2) Na2SiO3 и CuCI2 4) BaCI2 и Ca(NO3)2
20. Концентрация ионов Н + в чистой дистиллированной воде при 20˚С равно___ моль/л.
1) 7 2) 14 3) 10-7 4) 10-14
Кислотно - основное состояние ( КОС ) организма. Буферные системы крови
Буферные системы имеют большое значение в поддержании кислотно-основного равновесия организма. Внутриклеточные и внеклеточные жидкости всех живых организмов, как правило, характеризуются постоянным значением рН, которое поддерживается с помощью различных буферных систем. Значение рН большей части внутриклеточных жидкостей находится в интервале от 6,8 до 7,8.
Кислотно-основное равновесие в крови человека обеспечивается водородкарбонатной, фосфатной и белковой буферными системами.
Нормальное значение рН плазмы крови составляет 7,4±0,05. Этому соответствует интервал значений активной кислотности [H+] от 3,7 до 4,0х10-8 моль/л. Так как в крови присутствуют различные электролиты - НСО3-, Н2СО3, Н2РO4--, НРO42--, белки, аминокислоты, это означает, что они диссоциируют в такой степени, чтобы активность а(Н+) находилась в указанном интервале.
ПЛАЗМА КРОВИ. Водородкарбонатная буферная система НСО3-/Н2СО3 состоит из угольной кислоты Н2СО3 и сопряженного основания НСО3-. Это наиболее важная буферная система крови. Ее особенность состоит в том, что один из компонентов -угольная кислота - образуется при взаимодействии растворенного в плазме СО2 с водой:
СО2(р) + H2O « Н2СО3
Константа равновесия этой реакции:
[H2CO3]
К = ¾¾¾¾
[ СО2]р
где [CO2] p - концентрация растворенного CO2. Между СО2 в альвеолах и водородкарбонатным буфером в плазме крови, протекающей через капилляры легких, устанавливается цепочка равновесий:
+Н2О
Атмосфера(1) « [ СО2]г (2) « [ СО2]р (3) « Н2СО3 « Н+ + НСО3-
-Н2О
воздушное пространство легких плазма крови
В соответствии с уравнением Гендерсона-Гассельбаха рН водородкарбонатного буферного раствора определяется отношением концентрации кислоты Н2СО3 и соли NaНСО3
рН = рКа1(Н2СОз) + lg С(NаНСOз)/С(Н2СОз )
Согласно цепочке содержание Н2СОз определяется концентрацией растворенного CO2 , которая по закону Генри пропорциональна парциальному давлению CO2 в газовой фазе [СО2]р = КГр (CO2). В конечном счете оказывается, что с(H2СОз) пропорциональна р(СО2), и выражение принимает вид:
рН = 6,36 +lg С(NаНСОз) – lg р(СО2), где 6,36 - отрицательный десятичный логарифм константы диссоциации угольной кислоты рКа (Н2СОз) с поправкой на константу Генри; р(СО2) - пропорциональное давление CO2 в альвеолярных легких.
Водороднокарбонатная буферная система действует как эффективный буфер при рН = 7,4. При поступлении в кровь кислоты - доноров Н+ равновесие 3 смещается влево по принципу Ле-Шателье в результате того что Н+ связываются с НСОз- в молекулы Н2СОз. При этом концентрация Н2СОз повышается, а концентрация НСОз- соответственно понижается. Повышение концентрации Н2СОз в свою очередь приводит к смещению равновесия 2 влево. Это вызывает распад Н2СОз и увеличения концентрации CO2 , растворенного в плазме. В результате смещается равновесие 1 влево и давление CO2 в легких растет. Избыток CO2 выводится из организма. В результате описанных процессов водородкарбонатная система крови быстро приходит в равновесие с СО2 в альвеолах и эффективно обеспечивает поддержание постоянства рН плазмы крови. Ее буферная емкость по кислоте составляет Ва = 40 ммоль/л плазмы крови, а буферная емкость по щелочи Вв =1-2 ммоль/л плазмы крови.
Фосфатная буферная система HPО42-/H2PО4- состоит из слабой кислоты H2PО4- и сопряженного основания НРО42-. В основе ее действия лежит кислотно- основное равновесие:
Н2РО4- « H+ + НР042-
Фосфатная буферная система способна сопротивляться изменению рН в интервале 6,2-8,2 т.е. обеспечивать значительную долю буферной емкости крови. Из уравнения Гендерсона-Гассельбаха для этой буферной системы следует, что в норме при 7,4 отношение концентрации соли (НРО4-2) и кислоты (H2PО4-) примерно составляет 3,5:
рН = 7,4 = 6,86 +lg С(НР042-)/С(Н2Р04-), где 6,86 = рКа(H2PО4-)
Отсюда lg с(НР042-)/С(Н2Р04-) = 7,4 - 6,86 = 0,54 и С(HP042-)/С(H2P04-) = 3,5.
Фосфатная буферная система имеет более высокую емкость по кислоте, чем по щелочи. Ва=1-2 ммоль/л, Вв=0,5 ммоль/л. Поэтому фосфатная система участвует в нейтрализации как кислых так основных продуктов метаболизма. В связи с малым содержанием фосфатов в плазме крови она менее мощная, чем водороднокарбонатная буферная система.
Белковая буферная системасостоит из «белка-соли» и «белка-основания».
| R - CH - COO- + H+ « R - CH - COO- ½ ½ NH2 NH3+ белок основание белок соль |
Соответствующее кислотно-основное равновесие в среде, близкой к нейтральной, смещено влево и количество «белка-основания» преобладает.
Основную часть белка плазмы крови (»90%) составляют альбумины и глобулины. Буферная емкость, определяется белками плазмы, зависит от концентрации белков, их вторичной и третичной структуры и числа свободных протон акцепторных групп. Эта система может нейтрализовать как основные так и кислые продукты. Однако, вследствие преобладания форм «белок-основание» ее буферная емкость значительно выше по кислоте и составляет для альбуминов Ва=10 ммоль/л, для глобулинов Ва=3 ммоль/л.
Буферная емкость аминокислот плазмы крови незначительна как по кислоте, так и по щелочи. Это связанно с тем, что почти все аминокислоты имеют значение рКа, очень далекое от рКа=7. Поэтому при физиологическом значении их мощность мала. Практически только одна аминокислота-гистидин (рКа=6) обладает значительным буферным действием, при значениях близких к рН плазмы крови.
Таким образом, мощность буферных систем плазмы крови уменьшается в направлении
Уменьшение мощности буферных систем
¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾®
НСО3-/Н2СОз > белки > HP042-/H2P04- > аминокислоты
Эритроциты. Во внутренней среде эритроцитов в норме поддерживается постоянное рН=7,25. Здесь также действуют бикарбонатная, фосфатная и белковая буферные системы (гемоглобин-оксигемоглобин), поддерживая постоянную рН внутри эритроцитов, эти системы обеспечивают поддержание рН в целом в плазме крови. Гемоглобиновая буферная система тесно связанна с бикарбонатной. Так, рН в эритроцитах равно 7,25, что меняет соотношение концентрации соли (НСО3-) и кислоты (Н2СОз), оно здесь несколько меньше, чем в плазме крови. Из уравнения Гендерсона - Гассельбаха для буферных систем первого типа следует :
7,25 = 6,4 +lg С(НСОз-)/ С(Н2СОз),
где lgС(НСОз-)/С(Н2СОз) = 0,85 и отношение концентраций равно С(НСОз-)/ С(Н2СОз) = 7/1.
Фосфатная буферная система в клетках играет гораздо большую роль, чем в плазме. Прежде всего это связанно с тем, что в эритроцитах неорганических фосфатов больше чем в плазме крови. Кроме того, большое значение в поддержании постоянного значения рН играют эфиры фосфорных кислот, главное фосфолипиды, составляющие основу мембран эритроцитов.
Таким образом, в поддержании постоянства кислотно-щелочного равновесия в крови участвует ряд буферных систем, обеспечивающих кислотно-основной гомеостаз организма.
| Таблица 2 ЗНАЧЕНИЕ рН РАЗЛИЧНЫХ БИОЖИДКОСТЕЙ И ТКАНЕЙ ОРГАНИЗМА | |
| Биожидкость | РН (в норме) |
| Сыворотка крови | 7,40±0,05 |
| Слюна | 6,35-6,85 |
| Чистый желудочный сок | 0,9-1,1 |
| Моча | 4,8-7,5 |
| Спинномозговая жидкость | 7,40±0,05 |
| Сок поджелудочной железы | 7,5-8,0 |
| Содержимое тонкого кишечника | 7,5-8,0 |
| Желчь в протоках | 7,4-8,5 |
| Желчь в пузыре | 5,4-6,9 |
| Молоко | 6,6-6,9 |
| Водянистая влага глаза (слезная жидкость) | 7,40±0,10 |
| Кожа (внутриклеточная жидкость, различные слои) | 6,2-7,5 |
| Печень (внутриклеточная жидкость) | |
| купфферовские клетки | 6,4-6,5 |
| клетки по периферии долек | 7,1-7,4 |
| клетки в центре долек | 6,7-6,9 |
Смещение значения рН крови в кислую область от нормальной величины рН , равной 7,4, называется ацидозом, а в щелочную область - алкалозом.
Оценка нарушений кислотно-основного состояния (КОС) организма
Кислотно-основное состояние (КОС) определяется соотношением кислот и оснований во внутренней среде организма. Поддержание КОС осуществляется физико-химическими механизмами, обеспечивающими гомеостаз организма. Важнейшая роль в регуляции КОС принадлежит буферным системам крови (гидрокарбонатной, фосфатной, гемоглобиновой, белковой), немаловажную роль играют также физиологические процессы, происходящие в легких, почках, печени, желудочно-кишечном тракте. Среди органов, участвующих в регуляции КОС, ведущее место занимают легкие и почки. Через легкие удаляется избыток углекислого газа СО2, который образуется в процессе метаболизма углеводов, белков и жиров. Углекислый газ может также дополнительно выделяться легкими при разложении угольной кислоты - компонента гидрокарбонатной буферной системы, при увеличении в крови концентрации метаболитов кислой природы (органических гидрокси-, оксокислот). Почки участвуют в поддержании кислотно-основного состояния путем секреции (выведения) протонов и экскреции (задержке) бикарбонатов (ионов НСО3-).
На фоне различных заболеваний изменения абсолютных концентраций и соотношений между кислотами и основаниями могут быть связаны с отклонениями в метаболизме, либо обусловлены серьезными нарушениями в работе дыхательной системы (гипо- или гипервентиляция легких). В связи с этим различают метаболические и дыхательные нарушения КОС.
В клинической практике для оценки кислотно-основного состояния используют следующие показатели:
1. Величина рН, представляет собой отрицательный логарифм концентрации протонов (Н+) в артериальной крови (рН= - lg Н+). рН является наиболее жестким показателем КОС, в норме ее значение соответствует рН=7,4±0,05 (7,35- 7,45), отклонение рН не должно превышать 0,1. Изменение значений рН до 0,3 считаются несовместимым с жизнью.
2. Парциальное давление (напряжение) углекислого газа - рСО2, который находится в плазме крови в равновесии с угольной кислотой Н2СО3, растворенной при 38°. Величина рСО2 представляет собой дыхательный компонент кислотно-основного гомеостаза и характеризует функциональное состояние дыхательной системы. В норме рСО2 = 4 ,7 - 6,0 кПа или 35 - 45 мм рт. ст.
3. Стандартные бикарбонаты (SB) отражают уровень бикарбонат-ионов НСО3- в плазме крови, полностью насыщенной кислородом. У здоровых лиц величина показателя составляет SB = 20-27 ммоль/л. Бикарбонат-ионы представляют собой сопряженные основания, поэтому их концентрация может влиять на показатель КОС, оценивающий общую емкость буферных оснований (ВВ) крови.
4. Буферные основания (ВВ) крови представляют собой сумму всех анионов крови, обладающих буферными свойствами, т. е. в основном бикарбонатов и белковых ионов, при условии полного насыщения крови кислородом при температуре 38° С. Величина ВВ отражает состояние метаболического компонента кислотно-основного состояния. У здоровых лиц ВВ= 44 - 52 ммоль/л.
5. Параметром КОС является величина ВЕ (base excess), характеризующая отклонение от нормы концентрации буферных оснований. Избыток оснований, обозначается (+) (BE), показывает превышение фактической концентрации буферных оснований по сравнению с нормой (норме соответствует ВЕ= от -2,5 до +2,5 ммоль/л). Отрицательные значения (-) ВЕ свидетельствуют о недостатке оснований или об избытке в организме кислот. При введении в кровь оснований, например бикарбоната (гидрокарбоната) натрия значения ВЕ могут быть приближены к показателям нормы. Положительные значения (+)ВЕ, напротив, показывают, что в организме присутствует избыток оснований и недостаток кислот. Изменения ВЕ являются первичными при метаболических нарушениях КОС.
Виды нарушений кислотно-основного состояния (КОС)
При многих заболеваниях в крови количество кислот или оснований может существенно отклоняться от нормы. Эти состояния вызывают напряжения в функционировании регуляторных систем (буферных систем крови, дыхательной и выделительной системы), которые уже не смогут обеспечивать постоянство значений рН крови. При абсолютной или относительной недостаточности механизмов гомеостаза могут происходить нарушения КОС, которые характеризуются развитием состояний ацидоза или алкалоза.
Под ацидозом понимают состояние, при котором в крови появляется абсолютный или относительный избыток кислот, при этом часто повышается концентрация водородных ионов, а значение рН по сравнению с нормой уменьшается (рН ≤7,35).
Алкалоз характеризуется абсолютным или относительным увеличением количества оснований и понижением концентрации водородных ионов, при этом значение рН по сравнению с нормой увеличивается (рН≥7,45).
По механизмам возникновения различают 4 вида нарушений КОС, каждый из которых может быть компенсированным и декомпенсированным.
Метаболический ацидоз. Встречается при диабете, почечной недостаточности, при различных видах кислородного голодания тканей, сопровождающегося образованием недоокисленных продуктов обмена, представляющих собой соединения кислой природы. Кислородное голодание, возникающее при нарушении кровообращения в результате массивной кровопотери, прогрессирующей сердечно-сосудистой недостаточности, приводит к возникновению метаболического ацидоза. Указанное нарушение КОС отмечается также при гнойных заболеваниях (перитонит, абсцесс и др.).
Метаболический ацидоз является наиболее тяжелой формой нарушений кислотно-основного состояния.
Основными признаками метаболического ацидоза являются: отрицательные значения величины (-) ВЕ, указывающей на низкий уровень оснований, снижение абсолютных значений SB и ВВ, низкое рСО2. При этом первичными, наиболее важными показателями, характеризующими метаболический характер нарушений КОС, являются ВЕ и ВВ, тогда как рСО2 отражает компенсаторную реакцию легких (респираторный или дыхательный компонент).
При компенсированной форме метаболического ацидоза в ответ на увеличение количества кислот в крови снижается парциальное давление углекислого газа - рСО2 и общий уровень углекислоты. Величина рН при этом сохраняет нормальные значения.
При декомпенсированных состояниях метаболического ацидоза значение рН становится меньше, чем 7,35. Клинически при декомпенсированном метаболическом ацидозе наблюдаются расстройства сердечной деятельности, глубокое шумное дыхание, нарастает гипоксия и гипоксемия. При снижении рН ниже 7,2 наступает коматозное состояние.
Коррекцию КОС при декомпенсированном метаболическом ацидозе осуществляют введением в кровь бикарбоната натрия NaHCO3, что приводит к увеличению концентрации бикарбонат-ионов ( показателя SB). Бикарбонат-ионы при взаимодействии с протонами, присутствующими в крови, образуют угольную кислоту, за счет ее разложения увеличится рСО2, а значение рН при связывании протонов может увеличиться до нормы. При проведении этой процедуры важно не ввести в кровь избытка бикарбонат-ионов, которое может спровоцировать состояние дыхательного алкалоза.
Дыхательный (респираторный, газовый) ацидоз. Наступает вследствие снижения обьема альвеолярной вентиляции (массивные пневмонии, бронхиальная астма, обструктивная форма эмфиземы легких, рак легкого, высокая концентрация СО2 во вдыхаемом воздухе). При компенсированной форме дыхательного ацидоза рН не изменяется за счет действия компенсаторных механизмов. Дыхательный ацидоз характеризуется увеличением парциального давления углекислого газа в крови (рСО2 выше 45 мм рт. ст.) (рСО2 является первичным (определяющим) показателем дыхательного ацидоза). При этом величина SB (уровень бикарбонат-ионов – НСО3-) и ВВ (буферноя емкость оснований), ВЕ (недостаток оснований) могут существенно не отличаться от нормы или быть снижены (показатель ВЕ со знаком « - »).
Недостаточность компенсаторных механизмов может приводить к развитию декомпенсированного дыхательного ацидоза, при котором значения рН уменьшаются до значений, более низких, чем в норме.
Компенсация дыхательного ацидоза происходит за счет эффективного действия буферных систем (гидрокарбонатной, гемоглобиновой), а также за счет включения почечного механизма выведения протонов Н+ и задержки бикарбоната натрия (NaHСО3), что приводит к увеличению SB, ВВ, знак ВЕ сменяется на «+», рН увеличивается.
Механизм усиления легочной вентиляции и удаление протонов и СО2 практического значения не имеет, поскольку первичная легочная гиповентиляция обусловлена, как правило, тяжелой легочной патологией.
Метаболический алкалоз. Развивается в случаях потери кровью нелетучих кислот, возникает при рвоте, связанной со стенозом привратника, снижении концентрации хлорид-ионов при длительном приеме мочегонных препаратов (фуросемида, гипотиазида и др.), при интенсивном лечении кортикостероидами.
Компенсация при метаболическом алкалозе является неполной. Для частично компенсированного метаболического алкалоза характерно нормальные или несколько повышенные значения рН крови, отмечается избыток оснований (положительная величина ВЕ) (первичный, наиболее важный показатель метаболического алкалоза), увеличение ВВ, SB (концентрации стандартного бикарбоната), высокое парциальное давление СО2 в крови (рСО2).
Алкалоз может быть вызван применением экзогенных (привнесенных в организм) соединений, обладающих высокой основностью, например, наркотиков, алкалоидов (alkali – щелочеподобный). Передозировки наркотиков часто являются причиной летальных исходов по причине развития алкалоза.
Метаболический алкалоз легче предупредить, чем лечить. Компенсация метаболического алкалоза осуществляется за счет снижения объема альвеолярной вентиляции легких (гиповентиляции), которая может вызвать дыхательный ацидоз.
Дыхательный (респираторный, газовый) алкалоз. Развивается в случаях чрезмерного выделения СО2 из крови. Основными причинами дыхательного алкалоза являются: гипервентиляция при гипоксии и анемии, длительном плаче или криках. Дыхательный алкалоз наблюдают при органических или психических поражениях центральной нервной системы (учащенное дыхание на фоне возбуждения), перегревании, одышке, передозировке препаратов производных салициловой кислоты.
Для компенсированного дыхательного алкалоза характерно: нормальное значение рН крови, значительное уменьшение рСО2 (первичный показатель), компенсаторное уменьшение стандартного бикарбоната (SB), ВВ, дефицит оснований (-) ВЕ).
При декомпенсированном дыхательном алкалозе рН крови выше нормы, т.е. выше 7,45, а показатели SB и ВЕ могут иметь близкие к норме значения.
Компенсация дыхательного алкалоза осуществляется почками. Почки задерживают ионы Н+ и усиленно выделяют гидрокарбонат–ионы (НСО3-), что приводит к снижению значений SB, ВВ, уменьшению концентрации и появлению дефицита оснований - (-) ВЕ).
Для оценки КОС используют все указанные показатели. В таблице 1 представлен характер изменения параметров, используемых для диагностики основных нарушений КОС. Из табл. 1 видно, что значение рН не изменяется при компенсированных метаболическом и дыхательном ацидозе, а также дыхательном алкалозе.
Значение рН снижается при декомпенсированном дыхательном и метаболическом ацидозе, повышается при декомпенсированном дыхательном и метаболическом алкалозе.
Парциальное давление рСО2 снижается при компенсированном метаболическом ацидозе, компенсированном и декомпенсированном дыхательном алкалозе.
рСО2 повышается при компенсированном и декомпенсированном дыхательном ацидозе, частично компенсированном метаболическом алкалозе (умеренно).
рСО2 не изменяется при декомпенсированном метаболическом ацидозе, декомпенсированном метаболическом алкалозе.
Концентрация стандартных бикарбонатов (SB) уменьшается при компенсированном и декомпенсированном метаболическом ацидозе, компенсированном дыхательном алкалозе.
Показатель SB повышается при частично компенсированном и декомпенсированном метаболическом алкалозе, при компенсированном дыхательном ацидозе.
Уровень SB не изменяется при декомпенсированном дыхательном ацидозе, декомпенсированном дыхательном алкалозе.
О метаболической природе нарушений КОС однозначно свидетельствуют изменения показателя ВВ. При метаболическом ацидозе концентрация буферных оснований (ВВ) уменьшается по сравнению с нормой, а при метаболическим алкалозе, напротив, увеличивается.
Величина ВЕ имеет (+) значение лишь при метаболическом алкалозе и указывает на превышение количества оснований по сравнению с нормой. При всех остальных нарушениях ВЕ имеет отрицательные значения.
В периоде компенсации, повышение или понижение рСО2 при нормальных величинах рН и ВЕ характерно для соответствующих респираторных нарушений (дыхательный ацидоз или алкалоз).
Повышение или снижение ВЕ при компенсации и нормальных показателях рСО2 и рН соответствует метаболическим нарушениям кислотно-основного состояния (метаболическому алкалозу и ацидозу).
Приведенные выше данные показывают, что сопоставление параметров КОС с клинической картиной заболевания в большинстве случаев позволяет врачу достаточно надежно диагностировать характер нарушений даже в период их компенсации.
Таблица 3
Характер изменений параметров кислотно-основного состояния организма
| Пока-зате-ли | Ацидоз | Алкалоз | ||||
| Дыхательный | Метаболический | Дыхательный | Метаболический | |||
| Значение рН | При компенсированном состоянии N = (7,35-7,40) | |||||
| норма | норма | норма | (незначительно) | |||
| при декомпенсированном состоянии (7,19-6,80) | ||||||
| ¯ | ¯ | | | |||
| рСО2 | при компенсированном состоянии (N=35-45 мм рт. ст.) | |||||
| | ¯ | ¯ | (умеренно) | |||
| при декомпенсированном состоянии (N=35-45 мм рт.) | ||||||
| | норма или ¯ | ¯ | норма или | |||
| SB | при компенсированном состоянии (N=20-27 ммоль/л) | |||||
| | ¯ | ¯ | | |||
| при декомпенсированном состоянии (N=20-27 ммоль/л) | ||||||
| норма | ¯ | норма | | |||
| ВВ | при компенсированном состоянии (N=44-52 ммоль/л) | |||||
| норма | ¯ | | | |||
| при декомпенсированном состоянии (N=44-52 ммоль/л) | ||||||
| норма | ¯ | норма | | |||
| ВЕ | при компенсированном состоянии (N=0,0±2,5ммоль/л | |||||
| норма | ¯ | норма | | |||
| при декомпенсированном состоянии (N=0,0±2,5ммоль/л) | ||||||
| ¯ ( - ) | ¯ ( - ) | норма или ¯ (-) | ( + ) | |||
Ситуационные задачи
Задача 1. Больная О. страдает эмфиземой легких. При исследовании кислотно – основного состояния выявлено:
рН = 7,35 (N=7,40±0>0,05)
рСО2 = 56 мм рт .ст. (N =35-45 мм рт. ст.)
ВВ=50 ммоль/л (N = 44-52 ммоль/л)
SB=29ммоль/л (N=20-27 ммоль/л)
ВЕ=+ 8 ммоль/л (N=0,0±2,5ммоль/л)
Какое нарушение кислотно-основного состояния имеется у больной?
Решение: Значение рН=7,35 соответствует состоянию компенсированного ацидоза. Так как заболевание сопровождается возрастанием (↑) рСО2, то это дыхательный (газовый) ацидоз в стадии компенсации, которая ложится на почки: в результате выведения почками протонов Н+ и задержки бикарбоната натрия (NaHСО3) произошло увеличение показателей ВВ, ВЕ, SB. Таким образом, у больной состояние компенсированного дыхательного ацидоза.
Задача 2. Больной М. доставлен в стационар в тяжелом состоянии. У больного после каждого приема пищи появляется боль в поджелудочной области, сопровождающаяся рвотой. При исследовании кислотно-основного состояния выявлено:
рН=7,55 (N=7,40±0>0,05)
рСО2 =60 мм рт .ст. (N =35-45 мм рт. ст.)
ВВ=54 ммоль/л (N = 44-52 ммоль/л)
ВЕ=+18ммоль/л (N=0,0±2,5ммоль/л)
SB=29 ммоль/л (N=20-27 ммоль/л)
Какое нарушение кислотно-основного состояния имеется у больного?
Решение. Из анализа показателей КОС видно, что рН=7,55 превышает значения нормы, что свидетельствует о декомпенсированном состоянии алкалоза. Существенное увеличение значений показателей ВВ, SB и ВЕ и рСО2 свидетельствуют о метаболическом алкалозе. Таким образом, состояние больного М. характеризуется как метаболический алкалоз в декомпенсированной форме.
Задача 3. Больная Т. поступила в стационар с признаками сердечной недостаточности. При исследовании кислотно- основного состояния выявлено:
рН=7,35 (N=7,40±0>0,05)
рСО2 =30 мм рт. ст. (N =35-45 мм рт. ст.)
ВЕ= - 11,0 ммоль/л (N=-2,5 -+ 2,5ммоль/л)
SB=15 ммоль/л (N=20-27 ммоль/л)
ВВ= 40 ммоль/л (N = 44-52 ммоль/л)
Какое нарушение кислотно-основного состояния имеется у больной ?
Решение. По значению рН крови у больной выявлен ацидоз, при этом нарушение КОС компенсировано. Парциальное давление рСО2 снижено, что, указывает на метаболический характер нарушений. Показатели SB и ВВ снижены, а ВЕ имеет отрицательное значение, по абсолютной величине существенно отличающееся от нормы. Совокупность показателей КОС свидетельствует о метаболическом ацидозе в стадии компенсации. Следовательно, нарушения КОС у больной Т. соответствуют компенсированной форме метаболического ацидоза.
Задача 4. В стационар поступил больной А. с сепсисом. Показатели КОС имеют значения:
рН=7,28 (N=7,40±0>0,05)
рСО2=22 мм рт .ст. (N =35-45 мм рт. ст.)
SB=11 ммоль/л (N=20-27 ммоль/л)
ВЕ=-1ммоль/л (N=0,0±2,5ммоль/л)
ВВ=40 ммоль/л (N = 44-52 ммоль/л)
Какая форма нарушений кислотно-основного состояния выявлена у больного?
Решение. Видно, что значения рН крови по сравнению с нормой существенно снижены, что свидетельствует о декомпенсированном ацидозе. По сравнению с нормой снижено значение рСО2, что указывает на метаболический характер нарушений КОС. При этом снижены значения таких показателей как SB, ВВ, (-) ВЕ, характеризующих концентрацию и емкость буферных оснований крови. Таким образом, можно констатировать, что у больного А. наиболее тяжелая форма метаболического декомпенсированного ацидоза.
| <== предыдущая страница | | | следующая страница ==> |
| Определение осмотической концентрации и изотонического коэффициента раствора электролита» | | | Изучение зависимости скорости реакции от концентрации и температуры |
Дата добавления: 2014-09-10; просмотров: 2255; Нарушение авторских прав

Мы поможем в написании ваших работ!