
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Равновесия и обменные реакции в растворах электролитов
Теория слабых электролитов. Константа диссоциации. В растворах слабых электролитов процесс диссоциации протекает обратимо, т.е. идет до установления состояния равновесия, следовательно, к нему может быть применен закон действующих масс для обратимых процессов.
Обратимый процесс диссоциации слабого электролита характеризуется константой равновесия.
Так, для процесса диссоциации слабого электролита
КmАn D mКn+ + nАm–
можно записать константу равновесия:
|

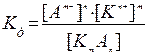 ,
,
где [Кn+], [Аm–], [КmАn] – равновесные концентрации компонентов; m и n – стехиометрические коэффициенты компонентов в уравнении диссоциации; Кд – константа равновесия для процесса диссоциации слабого электролита, называемая константой диссоциации..
Например, для процесса диссоциации уксусной кислоты
СН3СООН D СН3СОО- + Н+
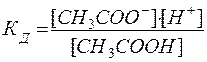 .
.
Кд представляет собой важную характеристику слабых электролитов, т.к. указывает на прочность их молекул в данном растворе. Чем меньше Кд в данном растворителе, тем слабее диссоциирует электролит и тем, следовательно, устойчивее его молекулы.
Как и любая константа равновесия, константа диссоциации зависит от природы растворенного вещества и растворителя, от температуры и не зависит от концентрации раствора.
С повышением температуры константа диссоциации обычно уменьшается. Например, константа диссоциации уксусной кислоты при 293, 298 и 373 К соответственно равна 1,85·10-5, 1,75·10-5, 1,35·10-5 (т.е. процесс диссоциации является экзотермическим).
Следует отметить, что строго законы химического равновесия применимы только к слабым электролитам, поэтому описание электролитической диссоциации законом действующих масс является одним из основных признаков слабых электролитов.
Между Кд и α существует количественная зависимость. Примем для процесса диссоциации бинарного электролита
КА D К+ + А–
молярную концентрацию растворенного вещества КА равной С, а степень диссоциации α, тогда равновесные концентрации ионов в растворе будут равны [А-] = [К+] = αС, а равновесная концентрация недиссоциированных молекул [КА] = С – αС, то
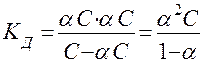 ,
,
где (1-α) – доля недиссоциированных молекул вещества. Полученное соотношение называется законом разбавления Оствальда. В случае слабых электролитов если α<<1, то
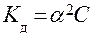 и
и 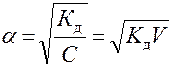 ;
;
здесь 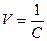 – разбавление раствора.
– разбавление раствора.
Значения Кд для разных электролитов приведены в справочной литературе.
Для расчетов, связанных с диссоциацией кислот, часто удобно пользоваться не константой Кд, а так называемым показателем константы диссоциации рК, который определяется соотношением
рК = – lg Кд.
Очевидно, что с возрастанием Кд, т.е. с увеличением силы кислоты, значение рК уменьшается; следовательно, чем больше рК, тем слабее кислота.
Степень диссоциации электролита α связана с изотоническим коэффициентом i соотношением:
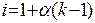 или
или 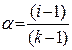 ;
;
здесь k – число ионов, на которые распадается при диссоциации молекула электролита (для КСl = 2, для ВаСl2 и Nа2SО4 k=3 и т.д.).
Таким образом, найдя по опытным величинам ∆р, ∆tзам и т.п. значение i, можно вычислить степень диссоциации электролита в данном растворе. При этом следует иметь в виду, что в случае сильных электролитов найденное таким способом значение α выражает лишь «кажущуюся» степень диссоциации, поскольку в растворах сильные электролиты диссоциированы полностью. Наблюдаемое отличие кажущейся степени диссоциации от единицы связано с межионными взаимодействиями в растворах сильных электролитов.
Теория сильных электролитов. В водных растворах сильные электролиты полностью диссоциируют, поэтому число ионов в них больше, чем в растворах слабых электролитов той же концентрации. И если в растворах слабых электролитов концентрация ионов мала, расстояние между ними велико и взаимодействие между ионами незначительно, то в не очень разбавленных растворах сильных электролитов среднее расстояние между ионами вследствие значительной концентрации сравнительно мало. Между ними возникает электростатическое взаимодействие, которое приво 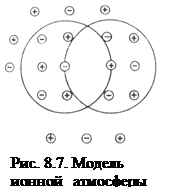 дит к тому, что катионы и анионы испытывают взаимное притяжение, а ионы одного знака заряда отталкиваются друг от друга. Благодаря притяжению каждый ион как бы окружен шарообразным роем противоположно заряженных ионов, получившим название «ионной атмосферы», в то время как ионы одноименного знака располагаются дальше (рис. 8.7). При этом ионы сольватируются (гидратируются), что также отражается на их свойствах и свойствах растворителя.
дит к тому, что катионы и анионы испытывают взаимное притяжение, а ионы одного знака заряда отталкиваются друг от друга. Благодаря притяжению каждый ион как бы окружен шарообразным роем противоположно заряженных ионов, получившим название «ионной атмосферы», в то время как ионы одноименного знака располагаются дальше (рис. 8.7). При этом ионы сольватируются (гидратируются), что также отражается на их свойствах и свойствах растворителя.
Впервые понятие «ионная атмосфера» предложено Дебаем и Хюккелем. Ионные атмосферы обладают следующими характерными особенностями:
· в их состав входят катионы и анионы, однако преобладают ионы, противоположные по знаку заряду центрального иона;
· cуммарный заряд ионной атмосферы равен по величине заряду центрального иона и противоположен ему по знаку;
· все ионы в растворе равноправны, поэтому каждый из них является центральным ионом и одновременно входит в состав ионной атмосферы другого иона;
· за счет теплового движения ионы, входящие в состав ионной атмосферы, постоянно меняются местами с ионами, находящимися за ее пределами, т.е. ионная атмосфера носит динамический характер.
Межионные силы влияют на все свойства растворов (электрическая проводимость, tкип и tзам, давление насыщенного пара, осмотическое давление). Так, в отсутствие внешнего электрического поля ионная атмосфера симметрична и силы, действующие на центральный ион, взаимно уравновешиваются. Если же приложить к раствору постоянное электрическое поле, то разноименно заряженные ионы будут перемещаться в противоположных направлениях. При этом каждый ион стремится двигаться в одну сторону, а окружающая его ионная атмосфера – в противоположную, вследствие чего направленное перемещение иона замедляется, а следовательно, уменьшается число ионов, проходящих через раствор в единицу времени, т.е. уменьшается сила тока. Чем больше концентрация раствора, тем сильнее проявляется тормозящее действие ионной атмосферы на электрическую проводимость раствора. Следовательно, в результате межионных взаимодействий все свойства раствора электролита, зависящие от концентрации ионов, проявляются так, как если бы число ионов в растворе было меньше, чем это соответствует полной диссоциации электролита.
Для оценки состояния ионов в растворе пользуются величиной, называемой активностью. Под активностью иона понимают ту эффективную, условную концентрацию его, соответственно которой он действует при химических реакциях. Активность иона a равна его истинной концентрации С, умноженной на коэффициент активности иона f:
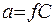 .
.
Коэффициент активности иона f - безразмерная величина, характеризующая степень отклонения свойств данного раствора от свойств идеального раствора:
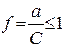 .
.
Коэффициенты активности зависят от природы растворителя и растворенного вещества, от заряда и природы иона, от концентрации раствора, от температуры.
В разбавленных растворах (С ≤ 0,5 моль/л) природа иона слабо сказывается на значении его коэффициента активности f. Приближенно можно считать, что в разбавленных растворах коэффициент активности иона f в данном растворителе практически не зависит от природы иона, зависит только от заряда иона и ионной силы раствора I, которая равна полусумме произведений концентрации С каждого иона на квадрат его заряда z:
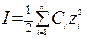 .
.
В химических справочниках значения f ионов в разбавленных растворах приводятся в зависимости от их зарядов z и ионной силы раствора I. Приближенно коэффициент активности иона в разбавленном растворе можно вычислить по формуле
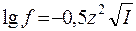 .
.
Активность и коэффициент активности можно определить на основании экспериментальных данных (по повышению tкип, понижению tзам, по давлению насыщенного пара над растворами и т.д.).
Подстановка величины активности (а) вместо концентрации (С) в уравнение закона действующих масс делает его справедливым при любых концентрациях.
Так, для обратимого процесса
КА D К+ + А– ,
отражающего диссоциацию слабого электролита в растворе, константа равновесия будет равна
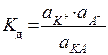 (термодинамическая константа диссоциации).
(термодинамическая константа диссоциации).
Для предельно разбавленных растворов (близких к идеальным), где отсутствуют силы взаимодействия ионов между собой из-за их отдаленности друг от друга, f= 1, т.е. a = С. При обсуждении последующего материала примем, что концентрации разбавленных растворов электролитов существенно не отличаются от их активностей.
Электролитическая диссоциация кислот, оснований и солей в воде.Молекулы кислот в воде диссоциируют на ионы водорода (гидроксония-гидратированный ион водорода) и на анионы кислотного остатка. Например, уравнение диссоциации азотной кислоты имеет вид
HNO3+H2O = H3O+ + NO3ˉ
или при упрощенной записи
НNО3 = Н+ + NО3ˉ.
Максимальное число ионов водорода, образующихся из одной молекулы кислоты, определяет ее основность, следовательно НNО3 - одноосновная кислота.
У сильных кислот, диссоциирующих нацело, свойства кислот проявляются в большей степени, у слабых – в меньшей. Чем лучше кислота диссоциирует, т.е. чем больше ее константа диссоциации, тем она сильнее. Например, азотная кислота более сильная, чем йодноватая, т.к. Кд (HNO3) = 4,36*10 > Кд(HIO3) = 1,7*10-1.
Многоосновные кислоты диссоциируют ступенчато, последовательно отщепляя один ион водорода за другим, и каждая ступень ионизации характеризуется определенной константой диссоциации. Если кислота слабая, то на всех ступенях процесс обратимый. Так, для ортофосфорной кислоты:
1. Н3РО4 D Н+ + Н2РО4ˉ 
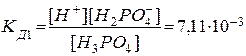 .
. 
2. Н2РО4ˉ D Н+ + НРО42- 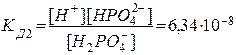 .
.
3. НРО42- D Н+ + РО43- 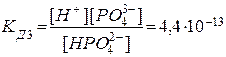 .
.
Из сопоставления приведенных выше значений констант диссоциации следует, что Кд1 > Кд2 > Кд3. Первый ион водорода отрывается от молекулы легче, последующие все труднее, т.к. возрастает отрицательный заряд кислотного остатка; поэтому в не очень разбавленных растворах фосфорной кислоты ионов РО43- мало. Неравенства Кд1 > Кд2 > …Кдn характерны и для других многоосновных кислот. Ориентировочно можно считать, что каждая последующая константа диссоциации меньше предыдущей в 105 раз. Они связаны между собой соотношением: КД= КД1* КД2*…*КДn.
Многоосновные сильные кислоты диссоциируют по первой ступени как сильные электролиты, а по второй – как электролиты средней силы, например:
Н2SО4 = Н+ + НSО4ˉ КД1=1*103,
НSО4- D Н+ + SО42- КД2=2*10-2.
Способность многоосновных кислот диссоциировать ступенчато объясняет их склонность к образованию кислых солей.
Сила кислородсодержащих кислот зависит от строения молекулы. Формулу кислородсодержащих кислот в общем виде можно записать ЭОm(OH)n, имея в виду, что в их молекулах имеются связи Н-О-Э и Э=О. Как показывают исследования, сила кислот практически не зависит от n (числа ОН-групп), но заметно возрастает с увеличением m (числа несвязанных в ОН-группы атомов кислорода, т.е. со связями Э=О). По первой ступени ионизации кислоты типа Э(ОН)n относятся к очень слабым (Кд1 = 10-8 – 10-11, рКд1=7-11), типа ЭО(ОН)n – к слабым (Кд1=10-2-10-4, рКд1=1,5-4), типа ЭО2(ОН)n – к сильным и типа ЭО3(ОН)n – к очень сильным (табл.8.2).
Таблица 8.2
Классификация кислородсодержащих кислот по их силе в водных растворах*
| Тип кислоты | Кислота | КД | рКД | Сила кислот |
| Э(ОН)n | HBrO | 2,06*10-9 | 8,7 | Очень |
| HClO | 3,2*10-8 | 7,5 | слабые | |
| HIO | 2,3*10-11 | 10,64 | ||
| H3AsO3 | 6*10-10 | 9,2 | ||
| H3BO3 | 5,8*10-10 | 9,24 | ||
| H4SiO4 | 2*10-10 | 9,7 | ||
| H6TeO6 | 2*10-8 | 7,7 | ||
| ЭО(ОН)n | HClO2 | 1,1*10-2 | 1,97 | Слабые |
| HNO2 | 5,7*10-4 | 3,29 | ||
| H2CO3 | 1,32*10-4 | 3,88 | ||
| H2SO3 | 1,3*10-2 | 1,87 | ||
| H3AsO4 | 6,46*10-3 | 2,19 | ||
| H3HO4 | 7,25*10-3 | 2,12 | ||
| H5IO6 | 3,1*10-2 | 1,57 | ||
| ЭО2(ОН)n | HBrO3 | 2*10-1 | 0,7 | Сильные |
| HClO3 | ~ -1 | |||
| HIO3 | 1,7*10-1 | 0,77 | ||
| HNO3 | 4,36*10 | ~ 1,64 | ||
| H2MnO4 | ~ 10-1 | - 1 | ||
| H2SO4 | 1*103 | -3 | ||
| ЭО3(ОН)n | HClO4 | ~ -10 | Очень | |
| HMnO4 | 1*103 | ~ 2,3 | сильные |
Примечание: *В таблице приведены значения КД первой ступени ионизации кислот.
Резкое возрастание силы в ряду кислот с увеличением m можно объяснить оттягиванием электронной плотности от связи Н-О на связь Э=О.
С увеличением степени окисления центрального атома Э изменение состава образуемых им кислородсодержащих кислот отвечает увеличению m, например:
+1 +3 +5 +7
HClO HClO2 HClO3 HClO4
Cl(OH) ClO(OH) ClO2(OH) ClO3(OH)
рКд=7,25 рКд=1,97 рКд=-1 рКд=-5
В этом проявляется общая закономерность: с увеличением степени окисления элемента в ряду его гидроксидов основные свойства ослабевают, кислотные – усиливаются, например:
+4
Mn(OH)4
+2 +3 +6 +7
Mn(OH)2 Mn(OH)3 H4MnO4 H2MnO4 HMnO4
основание основание амфотерное кислота кислота
средней слабое соединение сильная очень
силы сильная
Молекулы оснований в воде диссоциируют на катионы металлов (исключение - NН4ОН D NН4+ + ОН ˉ) и гидроксид- ионы. Например, уравнение диссоциации гидроксида натрия имеет вид
NаОН = Nа+ + ОН ˉ.
Максимальное число гидроксид-ионов, образующихся из одной молекулы основания, определяет его кислотность, следовательно, NaOH – однокислотное основание.
Чем больше константа диссоциации основания, тем оно сильнее. Например, гидроксид лития более сильное основание, чем гидроксид аммония, т.к. Кд(LiOH) = 6,75*10-1 > Кд (NH4OH) = 1,8*10-5.
Многокислотные основания диссоциируют ступенчато, последовательно отщепляя один гидроксид – ион за другим, и каждая ступень ионизации характеризуется определенной константой диссоциации. Если основание слабое, то на всех ступенях процесс протекает обратимо, например:
Fе(ОН)3 D Fе(ОН)2+ + ОН ˉ ,
Fе(ОН)2+ D Fе(ОН)2+ + ОН ˉ ,
Fе(ОН)2+ D Fе3+ + ОН ˉ .
Многокислотные сильные основания диссоциируют по первой ступени как сильные электролиты, а по второй – как электролиты средней силы, например:
Са(ОН)2 = СаОН+ + ОН ˉ,
СаОН+ D Са2+ + ОН ˉ.
Этим объясняется способность оснований многовалентных металлов образовывать основные соли, например Zn(ОН)Сl, Fе(ОН)Сl2 и др.
Гидроксиды многих металлов в водных растворах могут диссоциировать и по кислотному, и по основному типу. Соединения, которые в зависимости от условий проявляют как кислотные, так и основные свойства, называются амфотерными или амфолитами. Амфотерность электролитов объясняется малым различием прочности связей Э-О и О-Н. К амфотерным электролитам относятся : Zn(ОН)2, Al(ОН)3, Be(ОН)2, Ga(ОН)3, Cr(ОН)3, Ge(ОН)2, Sn(ОН)4, Pb(ОН)2 и др. Примером может служить диссоциация гидроксида цинка:
2H+ +[Zn(OH)4]2ˉ D Zn(OH)2 +2H2O D [Zn(H2O)2]2+ +2OH ˉ.
При этом в кислой среде равновесие сдвигается влево, в щелочной вправо. При взаимодействии гидроксида цинка, например, с азотной кислотой образуется нитрат цинка:
Zn(OH)2 + 2HNO3 D Zn(NO3)2 + 2H2O;
при взаимодействии же с гидроксидом калия – тетрагидроксоцинкат калия:
Zn(OH)2 + 2KOH D K2[Zn(OH)4].
Соли при электролитической диссоциации образуют катионы металлов (исключение соли аммония) или комплексные катионы и одноатомные или многоатомные анионы. Соли бывают средние (нейтральные, например, СаSО4), кислые (СаНРО4), основные (Zn(ОН)Сl).
Средние соли диссоциируют в одну стадию. Например,
Nа2SО4 = 2Nа+ + SО  .
.
В кислых солях отщепляется сначала ион металла по типу сильного электролита, затем - ионы водорода по типу слабого электролита. Например: NаН2РО4 = Nа+ + Н2РО 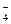 ,
,
Н2РО 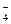 D Н+ + НРО
D Н+ + НРО  ,
,
НРО  D Н+ + РО
D Н+ + РО 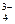 .
.
В последних двух ступенях равновесие сдвинуто влево, поэтому ионов Н+ в растворе очень мало.
В основных солях сначала отщепляется кислотный остаток по типу сильного электролита, затем - гидроксид–ионы по типу слабого электролита. Например,
(ZnОН)2SО4 = 2ZnОН+ + SО  ,
,
ZnОН+ D Zn2+ + ОН ˉ.
В последней стадии равновесие сдвинуто влево, поэтому ионов ОН ˉ в растворе мало.
Обменные реакции в растворах электролитов.В растворах электролитов реагирующими частицами являются ионы (точнее сольватированные или гидратированные ионы). Реакции, осуществляющиеся в результате обмена ионами между электролитами, называются ионообменными (или реакциями ионного обмена). Отличительной чертой реакций ионного обмена (РИО) является сохранение элементами всех веществ их степеней окисления (реакции протекают без изменения заряда ионов).
Различают обратимые и необратимые РИО. Все реакции между ионами обратимы, протекают очень быстро. Однако в некоторых случаях равновесие сильно смещено в сторону образования продуктов реакции из-за удаления их из сферы реакции (т.е. реакции практически идут до конца, необратимы). РИО протекают практически необратимо, если исходные компоненты – сильные электролиты и растворимые вещества, а в ходе реакции образуются:
- осадки (нерастворимые или малорастворимые);
- газообразные вещества;
- слабые электролиты (малодиссоциирующие вещества);
- комплексные соединения.
В уравнениях необратимых РИО принято ставить знак « = ».
Закономерности, характерные для обратимых ионнообменных реакций:
1. Реакция ионного обмена обратима (может протекать в двух направлениях), если среди исходных и образующихся веществ есть слабые электролиты, нерастворимые, малорастворимые или газообразные вещества или если и исходные, и образующиеся вещества являются растворимыми и сильными электролитами. В уравнениях таких реакций ставят знак обратимости «D».
2. Равновесие такой реакции смещается в направлении наиболее полного связывания ионов (их наименьшей концентрации в растворе).
Реакции обмена, написанные в молекулярной форме, не отражают особенностей взаимодействия между ионами в растворе. Сущность взаимодействия в растворах электролитов отражают ионно-молекулярные уравнения – полные и краткие. При составлении ионно-молекулярных уравнений:
1) сильные электролиты записывают в виде ионов;
2) слабые электролиты (малодиссоциирующие), нерастворимые, малорастворимые и газообразные вещества записывают в виде молекул с соответствующими значками ↓ или ↑;
3) краткое ионно-молекулярное уравнение получают из полного путем исключения из него тех ионов, которые присутствуют в неизменном виде и количестве в правой и левой частях.
Примеры:
1. Молекулярное уравнение:
ВаСl2 + Nа2SО4 = ВаSО4↓ + 2NаСl.
Полное ионно-молекулярное уравнение:
Ва2+ + 2Сl  + 2Nа+ + SО
+ 2Nа+ + SО  = ВаSО4↓ + 2Nа+ + 2Сl
= ВаSО4↓ + 2Nа+ + 2Сl  .
.
Сущность ионного процесса выражает краткое ионно-молекулярное уравнение:
Ва2+ +SО  = ВаSО4↓.
= ВаSО4↓.
Поскольку ВаSО4 выпадает в осадок, который не участвует в обратной реакции, то и равновесие рассматриваемого процесса сильно смещено вправо, т.е. реакция практически идет до конца (∆G°= -60 кДж).

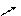 2. Nа2СО3 + Н2SО4 = Nа2SО4 +
2. Nа2СО3 + Н2SО4 = Nа2SО4 + 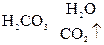 ,
,
2Nа+ + СО 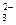 + 2Н+ + SО
+ 2Н+ + SО  = 2Nа+ + SО
= 2Nа+ + SО  + Н2О + СО2↑,
+ Н2О + СО2↑,
СО 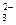 + 2Н+ = Н2СО3 = Н2О + СО2↑.
+ 2Н+ = Н2СО3 = Н2О + СО2↑.
В результате реакции получается газообразное вещество и слабый электролит.
3. 2КСN + Н2SО4 = 2НСN + К2SО4,
Н+ +СN  = НСN.
= НСN.
В результате реакции получается малодиссоциирующее соединение -НСN.
Обобщая этот пример, можно сделать вывод, что сильные кислоты вытесняют слабые из растворов их солей (аналогично сильные основания вытесняют слабые основания из растворов их солей).
К обменным ионным процессам относятся также реакции нейтрализации, в результате которых образуется слабый электролит – вода, например: НСl + КОН = Н2О + КСl,
Н+ + ОН ˉ = Н2О.
Реакции нейтрализации любых других сильных кислот и оснований протекают аналогично. Поскольку соль полностью диссоциирует на ионы, реакция в любом случае протекает лишь между ионами Н+ и ОН ˉ.
4. ZnСl2 + 4КОН = К2[Zn(ОН)4] + 2КCl,
Zn2+ + 4ОН‾ = [Zn(ОН)4]2‾.
В результате реакции образуется комплекс (комплексный ион).
5. НСN + СН3СООNа D СН3СООН + NаСN,
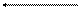
НСN + СН3СОО‾ D СН3СООН + СN‾.
 |
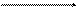 NН4ОН + НСl D Н2О + NН4Сl,
NН4ОН + НСl D Н2О + NН4Сl,
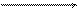 NН4ОН + Н+ D Н2О + NН4+.
NН4ОН + Н+ D Н2О + NН4+.
Слабые электролиты есть и в левой, и в правой частях уравнений реакций. Равновесие обратимого процесса в этих случаях смещается в сторону образования вещества, обладающего меньшей константой диссоциации. В первой реакции равновесие смещено влево (КНСN=4,9·10‾10, КСН3СООН=1,8·10‾5), во второй – вправо (КН2О=1,8·10‾16, КNН4ОН=1,8·10‾5). Это отвечает значениям ∆G°=43 кДж и (-84 кДж), соответственно, для первой и второй реакций.
Электролитическая диссоциация воды. Водородный показатель.Изучение тщательно очищенной от посторонних примесей воды показало, что она обладает определенной, хотя и незначительной электрической проводимостью, заметно возрастающей с повышением температуры. Так, при 273К удельная электрическая проводимость воды составляет 1,5·10-8 Ом-1·см-1, при 289К – 6,2·10-8 Ом-1·см-1.
Наличие электрической проводимости может быть объяснено только тем, что молекулы воды, хотя и в незначительной степени, распадаются на ионы, т.е. вода является слабым электролитом.
Процесс диссоциации воды может быть записан с учетом электростатического взаимодействия полярных молекул (самоионизации), в ходе которого образуются ионы гидроксония и гидроксид-ионы:
2Н2О D Н3О+ + ОН‾
или в упрощенной форме
Н2О D Н+ + ОН‾.
Выражение для константы электролитической диссоциации воды:
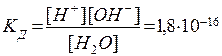 (при 25°С).
(при 25°С).
Ничтожно малая диссоциация воды позволяет считать концентрацию недиссоциированных молекул равной общей концентрации, которая для воды объемом 1л. составляет:
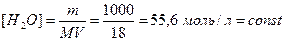 .
.
Найдем из выражения для Кд произведение двух постоянных при данной температуре величин:
Кд·[Н2О] = [Н+][ОН‾] = 1,8·10-16·55,6=10-14.
Произведение [Н+][ОН‾] называется ионным произведением воды (КВ; Kw). Это величина постоянная при данной температуре.
КВ= [Н+][ОН‾] = 10-14 – ионное произведение воды при 25°С.
Таким образом, для воды, разбавленных водных растворов кислот, щелочей, солей и др. соединений ионное произведение воды практически постоянная величина и зависит только от температуры. При 0°С КВ=0,113·10-14, при 25°С КВ= 10-14, при 100°С КВ= 55·10-14.
Растворы, в которых концентрация ионов водорода равна концентрации гидроксид-ионов, называют нейтральными. В чистой воде и нейтральных растворах при 25°С [Н+] = [ОН‾] =10-7 моль/л. Если [Н+] > 10-7 моль/л, то среда кислая; если [Н+] < 10-7 моль/л, то среда щелочная.
Для удобства количественной характеристики кислотных или щелочных свойств растворов введена величина, называемая водородным показателем (рН) – это отрицательный десятичный логарифм концентрации ионов Н+:
рН= – lg[Н+].
В нейтральной среде [Н+]=10-7 моль/л, рН= – lg10-7 = 7; в кислой среде рН < 7, в щелочной среде рН > 7.
Аналогично введен гидроксильный показатель (рОН) – это отрицательный десятичный логарифм концентрации гидроксид-ионов:
рОН= – lg[ОН¯].
Прологарифмируем с обратным знаком выражение для КВ при 25°С, используем введенные показатели рН и рОН и получим рН + рОН = 14.
Понятие об индикаторах.Индикаторы – вещества, меняющие свою окраску в определенной области значений рН раствора.
Индикаторами могут быть слабые органические кислоты HInd и основания IndOH, молекулы и ионы которых имеют разную окраску. Будучи введенными в исследуемый раствор, индикаторы диссоциируют по одному из следующих механизмов:
HInd D H+ + Ind¯ (а)
IndOH D Ind+ + OH¯ (б).
Так как процесс диссоциации слабых электролитов обратим, положение равновесия в схемах (а) и (б) зависит от кислотности исследуемого раствора.
В кислых растворах индикаторы, представляющие собой слабые кислоты, в соответствии с принципом Ле-Шателье находятся преимущественно в виде молекул и окраска раствора соответствует молекулярной форме индикатора НInd.
Индикаторы, являющиеся слабыми основаниями, в растворах кислот, напротив, будут находиться в своей ионной форме Ind+, которая обусловливает окраску раствора.
К числу индикаторов, представляющих собой слабые органические кислоты, принадлежат лакмус, фенолфталеин, феноловый красный, ализариновый желтый. К индикаторам, представляющим слабые основания, относятся, например, метиловый оранжевый, метиловый красный. Выбор того или иного индикатора определяется интервалом рН, в котором необходимо поддерживать кислотность исследуемого раствора.
Например, лакмус
НInd D H+ + Ind¯
красный синий
рН < 6 рН > 8
рН = 6÷8 область перехода рН (фиолетовый цвет).
Гетерогенное равновесие. Произведение растворимости.Подавляющее большинство веществ обладает ограниченной растворимостью в воде и других растворителях. Поэтому на практике часто приходится встречаться с системами, в которых в состоянии равновесия находятся осадок и насыщенный раствор электролита. Вследствие динамического характера равновесия скорость процесса растворения осадка будет совпадать со скоростью обратного процесса кристаллизации.
Например, возьмем насыщенный раствор нерастворимого сильного электролита ВаSО4. В растворе устанавливается гетерогенное равновесие между осадком (твердой фазой) электролита и ионами электролита в растворе:
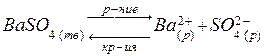 .
.
Его можно охарактеризовать с точки зрения закона действующих масс, записав выражение для константы гетерогенного равновесия К:
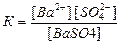 .
.
Преобразуем это выражение к виду: К[ВаSО4]=[Ва2+][SО42‾]; [ВаSО4]=const, как для твердого вещества, то К[ВаSО4]=const при данной температуре. Отсюда следует, что произведение концентраций ионов Ва2+ и SО42‾ также представляет собой постоянную величину. Это произведение называется произведением растворимости ПР:
ПР (BaSO4) = [Ва2+][SO42‾].
В общем виде для насыщенного раствора малорастворимого или нерастворимого сильного электролита АnBm, находящегося в равновесии с его твердой фазой, будет характерен следующий обратимый процесс:
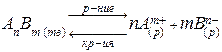 ,
,
для которого
ПР (AnBm) = [Аm+]n [Вn-]m.
Таким образом, гетерогенное равновесие «осадок – насыщенный раствор» подчиняется правилу произведения растворимости: произведение концентраций ионов электролита, содержащихся в его насыщенном растворе, возведенных в степени, соответствующие стехиометрическим коэффициентам, есть величина постоянная при данной температуре и называется произведением растворимости (ПР).
Из понятия ПР вытекают три следствия:
1. Условие образования осадка.
При увеличении концентрации одного из ионов электролита в его насыщенном растворе (например, путем введения другого электролита, содержащего тот же ион) произведение концентраций ионов становится больше ПР. При этом равновесие смещается в сторону образования осадка.
Осадок образуется, если произведение концентраций ионов, возведенных в степень стехиометрических коэффициентов, больше величины произведения растворимости: [Аm+]n·[Вn-]m > ПР (AnBm).
В результате образования осадка концентрация другого иона, входящего в состав электролита, тоже изменяется. Устанавливается новое равновесие, при котором произведение концентрации ионов электролита вновь становится равным ПР.
2. Условие растворения осадка.
Напротив, если в насыщенном растворе электролита уменьшить концентрацию одного из ионов (например, связав его каким-либо другим ионом), произведение концентраций ионов будет меньше значения ПР, раствор становится ненасыщенным, а равновесие между жидкой фазой и осадком сместится в сторону растворения осадка.
Осадок растворяется, если произведение концентраций ионов, возведенных в степень стехиометрических коэффициентов, меньше величины произведения растворимости: [Аm+]n·[Вn-]m < ПР (AnBm).
3. Условие получения одного малорастворимого соединения (II) из другого малорастворимого соединения (I): ПРII < ПРI. Например, химическое равновесие приведенной ниже реакции будет смещено вправо, в сторону образования AgI, т.к. ПР(AgI) = 1,5·10‾16 < ПР(AgCl) = 1,56·10‾10:
АgCl↓ + NaI D AgI↓ + NaCl
 |
AgCl↓ + I‾ D AgI↓ + Cl‾.
 |
Произведение растворимости характеризует растворимость вещества: чем больше ПР, тем больше растворимость. ПР – табличная величина. Исходя из значений ПР, можно выразить растворимость малорастворимых сильных электролитов в воде и растворах, содержащих другие электролиты.
Пример.
Произведение растворимости йодида свинца (II) при 20°С равно 8·10‾9. Вычислить растворимость соли (в моль/л) при указанной температуре.
| t=20°С ПР(PbI2)= 8·10‾9 | Решение. Уравнение гетерогенного равновесия в растворе: PbI2 (тв)↓ D Pb2+(р) + 2I‾(р). Обозначим искомую растворимость PbI2 через s (моль/л): s = С (PbI2). |
| S-? |
Концентрация растворившейся соли PbI2 в насыщенном растворе составляет s; за счет диссоциации данного сильного электролита в соответствии со стехиометрическими соотношениями в растворе содержится s моль/л ионов Pb2+ и 2s моль/л ионов I‾, т.е. [Pb2+]=s; [I‾]=2s.
Согласно правилу произведения растворимости и с учетом приведенных соотношений:
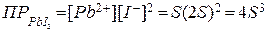 ,
,
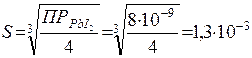 моль/л.
моль/л.
Ответ:S = 1,3*10-3 моль/л.
| <== предыдущая страница | | | следующая страница ==> |
| Растворы электролитов | | | Катионы |
Дата добавления: 2014-09-29; просмотров: 665; Нарушение авторских прав

Мы поможем в написании ваших работ!