
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ РЕАКЦИИ
В общем случае скорость химической реакции с повышением температуры увеличивается. Опыт показывает, что при повышении температуры на 10°С скорость реакции возрастает в 2—4 раза. Дляхарактеристики зависимости скорости химической реакции от температуры был введен температурный коэффициент скорости реакции g.Этот коэффициент является отношением константы скорости химической реакции при температуре Т +10° к константе скорости при температуре Т, т. е.
g = 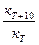 .
.
В среднем этот коэффициент равен трем. Следовательно, при изменении температуры на 100°С скорость реакции изменяется в 310 = 59049 раз. Пользуясь температурным коэффициентом скорости реакции, можно рассчитывать константы скоростей при различных температурах.
Прологарифмировав выражение , получим
lgkT+10 – lgkT = lgg.
Обозначив lgkT+10 - lgkT через Dlgk и разделив обе части этого уравнения на DT = 10, получим
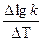 =
= 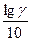 .
.
Если считать, что в пределах 10° температурный коэффициент остается постоянным, выражение можно записать так:
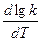 =
= 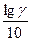 .
.
Проинтегрировав выражение, получим
lg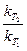 =
= 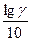 (T2-T1).
(T2-T1).
Приведенная выше оценка зависимости скорости химической реакции от температуры носит весьма приближенный характер и имеет малую практическую ценность. Более обоснованную зависимость константы скорости химической реакции от температуры можно получить с помощью уравнения изохоры или изобары химической реакции. Без индексов, характеризующих условия протекания процесса, уравнения изохоры и изобары запишутся одинаково:
 =
=  ,
,
где К = 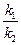 — константа химического равновесия; k1и k2 — константы скоростей прямой и обратной реакции; DH — теплота химической реакции; R — универсальная газовая постоянная; Т — абсолютная температура.
— константа химического равновесия; k1и k2 — константы скоростей прямой и обратной реакции; DH — теплота химической реакции; R — универсальная газовая постоянная; Т — абсолютная температура.
Подставив вместо константы равновесия отношение констант скоростей, получим
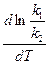 =
= 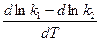 =
=  .
.
Запишем тепловой эффект как разность двух величин:
DH = E1 – E2.
Тогда выражение можно переписать так:
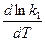 -
- 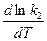 =
= 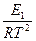 -
- 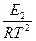 .
.
С точностью до постоянной величины В можно считать, что слагаемые правой и левой части попарно равны друг другу, т. е.,
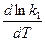 =
= 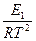 + B;
+ B;
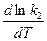 =
= 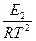 + B.
+ B.
Опыт показал, что B = 0. Поэтому, отбрасывая индексы, в общем виде уравнения можно записать следующим образом:
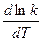 =
= 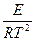 .
.
Это уравнение, получившее название уравнения Аррениуса,характеризует зависимость константы скорости химической реакции kот температуры Т. Величина Еимеет размерность энергии и носит название энергии активации. Энергию активации можно определить как тот избыток энергии по сравнению со средней энергией молекул при данной температуре, которой должны обладать молекулы, чтобы они могли вступить в химическую реакцию.
Уравнение легко проинтегрировать. Считая, что Е— величина постоянная, получим
lnk = -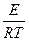 + lnC,
+ lnC,
где In С — константа интегрирования.
Если построить зависимость в координатах Ink—l/T, получим прямую линию
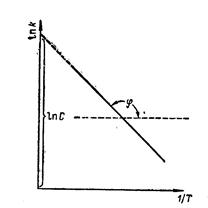
Отрезок, который отсекает эта прямая на оси ординат при 1/Т = 0, равен
In С, а тангенс угла j наклона прямой
tgj = -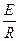 .
.
Отсюда можно определить величину энергии активации химической реакции.
Потенциируя выражение, получим
k = Ce - .
Из этого уравнения видно, что константами, характеризующими реакцию, являются предэкспоненциальный множитель Си энергия активации Е. Чем больше значение Е, тем меньше (при данном С) скорость химической реакции.
Если выражение проинтегрировать в пределах от T1 до Т2, то получим
ln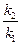 =
= 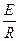
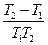 ,
,
где k2 — константа скорости химической реакции при температуре T2;k1— то же при температуре T1
Таким образом, зная величину k1при какой-либо температуре T1, можно вычислить k2при температуре T2.
Связь энергии активации с тепловым эффектом реакции можно проиллюстрировать с помощью представления об энергетическом барьере.Химическую реакцию можно представить как переход системы из энергетического состояния I в энергетическое состояние II, сопровождающийся теплотой DH.
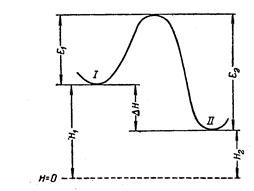
Из рисунка видно, что переход из состояния I в состояние II возможен при затрате энергии Е1; обратный переход возможен при затрате энергии Е2. При осуществлении реакции в прямом направлении выделяется количество энергии
-DH = Е2 - Е1.
Величина QPравна (по закону Гесса) разности энтальпий исходных и конечных продуктов реакции
-DH = H1 - H2 ,
отсчитываемых от некоторого исходного значения, принятого за нулевое
(H = 0).
| <== предыдущая страница | | | следующая страница ==> |
| МЕТОДЫ ОПРЕДЕЛЕНИЯ ПОРЯДКА РЕАКЦИИ | | | ТЕОРИЯ АКТИВНЫХ СТОЛКНОВЕНИЙ МОЛЕКУЛ |
Дата добавления: 2014-03-11; просмотров: 623; Нарушение авторских прав

Мы поможем в написании ваших работ!