
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
МЕТОДЫ ОПРЕДЕЛЕНИЯ ПОРЯДКА РЕАКЦИИ
Вид дифференциального уравнения скорости химической реакции устанавливается на основании опытных данных по зависимости концентраций реагирующих веществ и продуктов реакции от времени. Концентрации определяются обычными химическими или физико-химическими методами анализа (например, измерение оптической плотности, электропроводности, потенциала электрода, диэлектрической постоянной, теплопроводности газовой смеси и др.). Для определения дифференциального уравнения скорости химической реакции необходимо определить как общий порядок реакции, так и порядок по отдельным компонентам реагирующей системы. Для определения порядка реакции можно использовать следующие методы.
1. Метод подстановки. Иногда порядок реакции можно установить, проверив, какое из уравнений лучше описывает опытные данные. Для этого по опытным значениям концентраций в различные моменты времени рассчитывают константу скорости реакции по уравнению первого, второго и третьего порядка. Можно считать, что уравнение описывает процесс, если полученные по нему значения констант колеблются около какой-то средней величины, и отклонения от среднего значения лежат в пределах возможных ошибок определения.
2. Графический метод. Зависимость концентрации от времени для реакций различных порядков может быть выражена прямой линией, если выбрать соответствующую систему координат. Так, для реакции первого порядка прямая получается в системе координат lgc — t, для второго порядка при с01=с02 в системе — t и для третьего порядка в системе — t. По тангенсу угла наклона прямых можно определить константу скорости реакции.
3. Метод определения времени половинного превращения. Время половинного превращения для реакций различного порядка по-разному зависит от начальной концентрации реагентов. Для реакции первого порядка t1/2=, не зависит от с0; для реакции второго порядка t1/2 = , обратно пропорционально с0; для реакции третьего порядка t1/2=3 1/(2kс20 ), обратно пропорционально c02. Проведя опыты с различными начальными концентрациями реагирующих веществ, найдя t1/2, можно сделать вывод о порядке реакции.
t` = k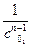 ;
;
t`` = k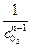 ;
;
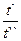 = (
= (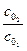 )n-1;
)n-1;
lg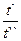 = (n-1)lg
= (n-1)lg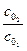 ;
;
n = 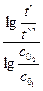 + 1.
+ 1.
4. Метод Вант-Гоффа.Проводится два опыта, в которых начальные концентрации вещества, по которому определяется порядок реакции, равны c1и c2 (концентрации других веществ во много раз больше). Тогда скорости реакции в первом и втором опытах будут:
-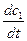 = kc1n;
= kc1n;
-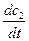 = kc2n.
= kc2n.
Поделим эти уравнения, прологарифмируем и найдем:
lg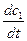 - lg
- lg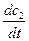 = n(lgc1 – lgc2);
= n(lgc1 – lgc2);
n = 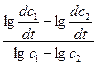 ;
;
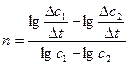 .
.
5. Метод изоляции, или метод избытка реагента. По этому методу, предложенному Оствальдом, проводят серию опытов, в каждом из которых изучается влияние концентрации только одного из исходных веществ на скорость реакции. Для этого все остальные исходные вещества берут в таком избытке, по сравнению с исследуемым, чтобы их концентрации в ходе реакции можно было считать практически постоянными. Составляют кинетические уравнения и определяют порядок реакции по каждому из исследуемых исходных веществ при помощи первого, второго или третьего способов. Сумма порядков реакций по всем исходным веществам представляет собой порядок реакции в целом.
| <== предыдущая страница | | | следующая страница ==> |
| Подставим выражение в уравнение. Тогда | | | ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ РЕАКЦИИ |
Дата добавления: 2014-03-11; просмотров: 961; Нарушение авторских прав

Мы поможем в написании ваших работ!