
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Термохимия
|
Читайте также: |
Закон Гесса составляет теоретическую основу термохимии.
Термохимией называют раздел химической термодинамики, в котором рассматривается применение закона Гесса для вычисления тепловых эффектов различных физико-химических процессов: химических реакций, процессов растворения, кристаллизации и других.
Тепловым эффектом химической реакции называется количество теплоты, которое выделяется или поглощается при необратимом протекании реакции, когда единственной работой является работа расширения. При этом температуры исходных веществ и продуктов реакции должны быть одинаковы.
Тепловой эффект реакции зависит от агрегатного состояния реагентов, поэтому в термохимических уравнениях указывают агрегатное состояние вещества. Принято два вида обозначений – скобками или буквенными индексами: [ ] или (т) – твердые вещества;
{ } или (ж) – жидкие вещества;
( ) или (г) – газообразные вещества.
При записи термохимического уравнения указывают также тепловой эффект реакции, применяя одну из двух форм записи:
а) суммируя тепловой эффект непосредственно в правой части уравнения (при этом знак “плюс” означает, что теплота выделяется в результате реакции);
б) записывая его отдельно под термохимическим уравнением, как это показано в приведенном ниже примере, (1.27), при этом знак “плюс” означает, что тепло поглощается системой, а знак “минус”, что процесс является экзотермическим.
Пример термохимического уравнения:
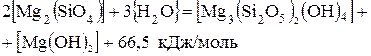 (1.26)
(1.26)
DH° = -66,5 кДж/моль (1.27)
Реакция идет с выделением тепла, т.е. является экзотермической.
Для того чтобы сравнивать тепловые эффекты различных процессов и производить термохимические расчеты, необходимо привести их к каким-то одинаковым условиям. Для этого введены понятия “стандартные условия”,“стандартное состояние” вещества и “стандартный тепловой эффект”. За стандартные условия приняты Т=298К (25°С) и Р=1,013×105 Па (1 атм.). Стандартным состоянием вещества называют наиболее устойчивое физическое состояние в стандартных условиях. Стандартный тепловой эффект – это тепловой эффект при стандартных условиях. Его обозначают индексом “°”, например, DU°, DH°, cм. уравнение (1.27).
Большое практическое значение закона Гесса заключается в том, что, пользуясь им, можно вычислять неизвестную теплоту реакции путем комбинирования термохимических уравнений других реакций, для которых тепловые эффекты известны. Это особенно важно, когда экспериментально определить теплоту реакции невозможно.
Пример
Сгорание углерода, как известно, возможно до СО и до СО2:
1) C(T) + 1/2 O2 ® СО(г) + DН1
2) С(T) + О2(г) ® СО2(г) + DН2
Тепловой эффект второй реакции легко определяется экспериментально. Он составляет DН2° = -393,5 кДж/моль. Что же касается первой реакции, то ее в чистом виде выделить практически не удается, всегда наряду с окислением углерода до СО идет и образование СО2. Как же определить теплоту сгорания углерода именно до СО, т.е. DН1? Воспользуемся для этого еще одной реакцией, тепловой эффект которой DН3 тоже довольно просто измеряется экспериментально:
3) СО(г) + 1/2 O2(г) = СО2(г) + DН3
DН3° = -283 кДж/моль
Запишем 2 и 3-е уравнения таким образом, чтобы после их алгебраического сложения получить нужную реакцию (уравнение 1):

____________________________
С(т) + 1/2 O2(г) = СО(г) + DН2 - DН3
Следовательно, DН1° = DН2° - DН3°
или DН1° = -393,5 + 283 = -110,5 кДж/моль.
Таким образом, закон Гесса позволяет определять тепловые эффекты реакций, для которых их экспериментальное определение затруднено.
В термохимических расчетах кроме самого закона Гесса широко применяют три его следствия.
Первое следствие закона Гесса:
тепловой эффект прямой реакции равен тепловому эффекту обратной реакции с противоположным знаком.
Второе следствие закона Гесса:
тепловой эффект реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ:
 (1.28)
(1.28)
где DHf – теплота образования вещества i, νi- стехиометрические коэффициенты в уравнении реакции.
Теплотой образования называют количество теплоты, которое выделяется или поглощается при образовании 1 моля вещества из простых веществ, взятых в устойчивом состоянии при рассматриваемыхусловиях (Р, Т).При этом теплота образования простых веществ (Н2, О2, S, C, N2 и т.д.) принята равной нулю.
Примечание. Образование вещества из простых веществ не всегда практически осуществимо, в таких случаях тепловой эффект относится к гипотетической реакции или гипотетическому состоянию.
Третье следствие закона Гесса:
тепловой эффект реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции:
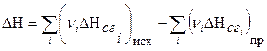 (1.29)
(1.29)
Теплотой сгорания называют количество теплоты, которое выделяется при полном сгорании одного моля вещества до высших оксидов при данных условиях (Р, Т). Если исходные вещества и продукты реакции находятся в стандартных состояниях, то и теплота сгорания называется стандартной. В приведенном выше примере, теплотой сгорания углерода будет являться тепловой эффект реакции (2), но не (1). Стандартные теплоты образования и сгорания веществ DH°f, DH°сг приводятся в справочной литературе. Многие из них определены экспериментально методом калориметрии. С этим методом студенты знакомятся на лабораторных занятиях. Употребляемые в данном параграфе обозначения тепловых эффектов через изменение энтальпии, говорят о том, что мы рассматриваем реакции в условиях P=const, когда Qp = DH.
Между теплотами образования веществ в различных агрегатных состояниях существуют, согласно закону Гесса, следующие соотношения:
DHf(г) = DHf(т) + DHвозг. = DHf(ж) + DHисп. (1.30)
DHf(ж) = DHf(т) + DHпл. (1.31)
DHвозг. = DHпл. + DHисп., (1.32)
где DHпл., DHисп., DHвозг. – теплоты плавления, испарения и возгонки
1 моля химического соединения.
Для реакций, протекающих в растворах, при расчетах теплоты реакции необходимо учитывать тепловой эффект процесса растворения вещества в данном растворителе. По закону Гесса, теплота образования вещества в растворе равна сумме его теплоты образования в чистом виде и теплоты его растворения. Теплота растворения зависит от концентрации вещества в растворе. Различают интегральную и дифференциальную теплоту растворения.
Интегральной теплотой растворения называется теплота, которая выделяется (или поглощается) при растворении одного моля вещества в таком количестве растворителя, чтобы образовался раствор с определенной моляльностью “m” (моляльность – способ выражения концентрации: число молей в 1 литре растворителя). На рис. 1.2 приведена зависимость интегральной теплоты растворения DHm от моляльности образующегося раствора m. DH0 – первая интегральная теплота растворения (теплота растворения 1 моля вещества в бесконечно большом количестве растворителя).
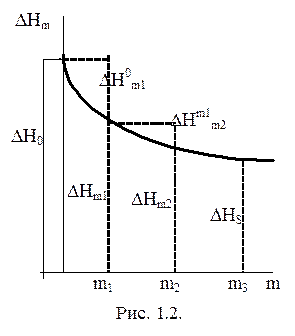
|
Рис. 1.2. Зависимость
интегральной теплоты
растворения DHm
от моляльной концентрации
образующегося раствора
DHs – последняя или полная интегральная теплота растворения - это теплота растворения 1 моля вещества в таком количестве растворителя, чтобы образовался насыщенный раствор.
Дифференциальной теплотой растворения называется теплота растворения 1 моля вещества в большом объеме раствора определенной концентрации. Понятие “большой объем” означает, что при добавлении к раствору 1 моля вещества его состав остается практически постоянен.
Зная интегральные теплоты растворения, можно вычислить теплоту разведения. Разведение – это добавление растворителя к раствору. Различают интегральную и промежуточную теплоты разведения.
Интегральной теплотой разведения DH0m1 называют теплоту разбавления раствора, содержащего 1 моль растворенного вещества, до бесконечно разбавленного (т.е. до m=0), рис. 1.2.
DH0m1 = DH0 - DHm1 (1.33)
Промежуточной теплотой разведения DHm1m2 называют тепловой эффект разбавления раствора, содержащего 1 моль растворенного вещества от концентрации m2 до меньшей концентрации m1. Она равна разности соответствующих интегральных теплот растворения (рис. 1.2):
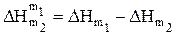 (1.34)
(1.34)
Теплота растворения твердого кристаллического вещества (KCl, CuSO4 и т.п.) определяется в основном энергетикой двух процессов:
1) разрушение кристаллической решетки; этот процесс всегда требует затраты энергии, его тепловой эффект всегда положителен;
2) сольватация образующихся ионов молекулами растворителя; этот процесс всегда сопровождается выделением тепла, т.е. отрицательным тепловым эффектом.
В зависимости от соотношения этих двух составляющих, теплота растворения кристаллического вещества может быть положительна (KCl, NaCl, KBr и т.п.) или отрицательна (CuSO4, CaCl2, ZnSO4).
При нейтрализации кислоты основанием происходит выделение тепла. Тепловой эффект таких реакций называется теплотой нейтрализации. При нейтрализации любой сильной кислоты любым сильным основанием происходит по сути одна и та же реакция[1]*, которая сопровождается выделением одного и того же количества тепла:
H+ + OH-= H2O (1.35)
DH = -55,9 кДж/моль
Если кислота или основание – слабые, то часть теплоты расходуется на диссоциацию слабого электролита:
+HA = H++ А-+ DНдисс. (1.36)
Н++ ОН-= Н2О - 55,9 кДж/моль (1.37)
НА + ОН-= Н2О + А-+ DНнейтр (1.38)
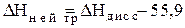 кДж/моль. (1.39)
кДж/моль. (1.39)
Расчеты по теплоте растворения имеют большое значение для определения тепловых эффектов.
| <== предыдущая страница | | | следующая страница ==> |
| Применение первого закона термодинамики к различным процессам. Закон Гесса | | | Теплоемкость. При термохимических расчетах используются теплоемкости твердых, жидких и газообразных веществ при различных температурах |
Дата добавления: 2014-10-02; просмотров: 575; Нарушение авторских прав

Мы поможем в написании ваших работ!