
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Теплоемкость. При термохимических расчетах используются теплоемкости твердых, жидких и газообразных веществ при различных температурах
|
Читайте также: |
При термохимических расчетах используются теплоемкости твердых, жидких и газообразных веществ при различных температурах.
Теплоемкостью вещества называется количество теплоты, необходимое для нагревания данной массы вещества на 1°. Различают удельную и мольную теплоемкости. Удельная теплоемкость отнесена к единице массы вещества, выраженной в граммах или килограммах; мольная - к 1 молю вещества. Если понятие теплоёмкость применяют к системе вцелом, то теплоёмкостью системы называют количество теплоты, необходимое для нагревания на один градус всей системы. Это понятие широко применяется, например, в методе экспериментального определения тепловых эффектов, который называется калориметрией. В данном разделе курса мы будем в основном говорить о теплоёмкости веществ.
В зависимости от условий, различают теплоемкость при постоянном объеме Cv, и при постоянном давлении Сp. Различают также истинную и среднюю теплоемкости. Средней теплоемкостью 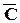 в интервале температур от Т1 до Т2 называют количество теплоты, подведенное к 1 молю (грамму) вещества, отнесенное к разности температур
в интервале температур от Т1 до Т2 называют количество теплоты, подведенное к 1 молю (грамму) вещества, отнесенное к разности температур
Т2 - Т1:
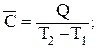
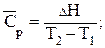
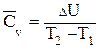 (1.40)
(1.40)
Истинной теплоемкостью называют отношение бесконечно малого количества теплоты dQ, которое нужно подвести к 1 молю (грамму) вещества, к бесконечно малому приращению температуры, которое при этом происходит, dT:
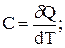

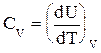 (1.41)
(1.41)
Размерность теплоемкости Дж/г×К; Дж/моль×К. Из уравнений 1.40 для “n” моль вещества:
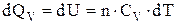 (1.42)
(1.42)
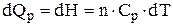 (1.43)
(1.43)
или в интегральной форме:
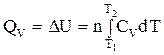 (1.44)
(1.44)
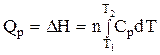 (1.45)
(1.45)
В уравнениях (1.44) и (1.45) QV и Qp представляют собой теплоту процесса нагревания “n” молей вещества от Т1 до Т2.
Если в рассматриваемом интервале температур теплоемкость вещества постоянна (то есть не зависит от температуры), то
 (1.46)
(1.46)
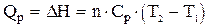 (1.47)
(1.47)
В общем случае теплоемкость зависит от температуры, поэтому при достаточно большом различии Т1 и Т2 (как правило, сотни градусов) СV и СP нельзя выносить за знак интеграла в уравнениях (1.44) и (1.45). Зависимость теплоемкости от температуры определяется экспериментально и может быть представлена в виде степенного ряда с полуэмпирическими коэффициентами:
 (1.48)
(1.48)
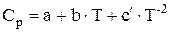 (1.49)
(1.49)
где а, b, c, 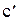 - коэффициенты, численные значения которых для различных веществ приведены в справочной литературе.
- коэффициенты, численные значения которых для различных веществ приведены в справочной литературе.
Уравнения (1.48), (1.49) справедливы только в том интервале температур, в котором они изучены экспериментально.
Мольные теплоемкости идеальных газов Cp и Cv , по уравнению Майера, связаны соотношением:
Cp - Cv = RТ (1.50)
где R = 8,314 Дж/моль×К - универсальная газовая постоянная.
Зная истинную теплоемкость, можно определить среднюю для данного интервала температур:
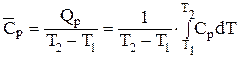 (1.51)
(1.51)
В дальнейшем мы будем использовать эти соотношения при расчете тепловых эффектов и рассмотрении некоторых термодинамических потенциалов.
| <== предыдущая страница | | | следующая страница ==> |
| Термохимия | | | Влияние температуры на тепловые эффекты различных процессов. Закон Кирхгофа |
Дата добавления: 2014-10-02; просмотров: 555; Нарушение авторских прав

Мы поможем в написании ваших работ!