
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Влияние температуры на тепловые эффекты различных процессов. Закон Кирхгофа
Тепловые эффекты химических реакций и других процессов зависят от температуры и эта зависимость устанавливается законом Кирхгофа. Пользуясь им, можно определять тепловой эффект процесса при любой температуре расчетным путем.
Получим уравнения Кирхгофа в дифференциальной форме. Для этого возьмем частные производные от теплоты процесса по температуре, соответственно, при постоянных P и V. Тогда с учетом уравнений (1.41) получим:
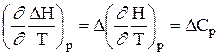 (1.52)
(1.52)
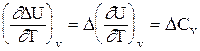 (1.53)
(1.53)
Уравнения (1.52) и (1.53) представляют собой дифференциальную форму закона Кирхгофа. Запишем уравнения Кирхгофа, перейдя к полным дифференциалам:

 (1.54)
(1.54)
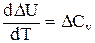 (1.55)
(1.55)
здесь ΔСp и ΔСv - изменение теплоемкости системы в результате протекания процесса при Р = const и V = const.
Формулировка закона Кирхгофа:
Температурный коэффициент теплового эффекта процесса равен изменению теплоемкости в результате протекания этого процесса.
Поясним, как же определить DСр и DСv.
Рассмотрим химическую реакцию:

 аА + вВ еЕ + dD (1.56)
аА + вВ еЕ + dD (1.56)
для нее изменение теплоемкости при Р = const:
 (1.57)
(1.57)
т.е.  (1.58)
(1.58)
где  - мольные теплоемкости продуктов реакции,
- мольные теплоемкости продуктов реакции,
 - мольные теплоемкости исходных веществ,
- мольные теплоемкости исходных веществ,
a, b, d, e, ν - стехиометрические коэффициенты в уравнении реакции.
Анализ уравнений (1.54) и (1.55) показывает, что
если DСр > 0, то  ;
;
если DСр < 0, то  ;
;
если DСр = 0, то  .
.
Это значит, что если изменение теплоемкости в ходе реакции положительно, то с ростом температуры тепловой эффект реакции возрастает; если изменение теплоемкости в ходе реакции отрицательно, то с ростом температуры тепловой эффект уменьшается; если в ходе процесса суммарная теплоемкость системы постоянна, то тепловой эффект реакции не зависит от температуры.
Проинтегрируем уравнения Кирхгофа:
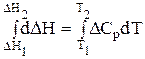 (1.59)
(1.59)
где DН1 и DН2 - тепловой эффект процесса, соответственно при Т1 и Т2 (при постоянном давлении).
Если интервал температур от Т1 до Т2 невелик (десятки градусов), то часто можно принять, что теплоемкости веществ не зависят от температуры, тогда в уравнении (1.59) DСр = const и эта величина выносится за знак интеграла:
DН2 = DН1 + DСр(Т2 - Т1) (1.60)
В общем случае для вычисления теплового эффекта по уравнению (1.59) нужно знать зависимость DСр от Т. Она находится следующим образом. Для каждого реагента и продукта реакции по справочным данным находят коэффициенты уравнения (1.48) или (1.49) (вид функции определяется типом вещества и указывается в справочнике). Записывают эти уравнения с численными значениями коэффициентов для каждого вещества. Затем, производя алгебраическое сложение, находят уравнение для DСр реакции по формуле (1.58). Получают зависимость DСр от Т в виде степенного ряда, который подставляют в уравнение (1.59) под знак интеграла вместо DСр:
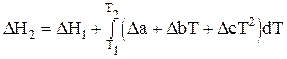 (1.61)
(1.61)
или
 (1.62)
(1.62)
Решение интегралов (1.61) и (1.62) приводит к виду уравнений Кирхгофа в интегральной форме:
 (1.63)
(1.63)
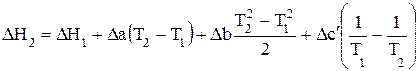 (1.64)
(1.64)
Уравнения (1.60), (1.63), и (1.64) используют для определения тепловых эффектов при температуре Т2, если известен тепловой эффект при температуре Т1.
В качестве DН1 чаще всего используют стандартные тепловые эффекты 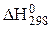 , которые рассчитывают, пользуясь следствиями закона Гесса, [уравнения (1.28) и (1.29)], а также справочными данными о теплотах образования или теплотах сгорания веществ.
, которые рассчитывают, пользуясь следствиями закона Гесса, [уравнения (1.28) и (1.29)], а также справочными данными о теплотах образования или теплотах сгорания веществ.
| <== предыдущая страница | | | следующая страница ==> |
| Теплоемкость. При термохимических расчетах используются теплоемкости твердых, жидких и газообразных веществ при различных температурах | | | Основные термодинамические понятия |
Дата добавления: 2014-10-02; просмотров: 679; Нарушение авторских прав

Мы поможем в написании ваших работ!