
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Основные термодинамические понятия
Все процессы, в которых один вид энергии преобразуется в другой, строго подчиняются первому закону термодинамики. Однако, он не дает возможности определить направление процесса, возможность протекания его в данном направлении и сделать вывод о том, насколько глубоко идет процесс в данном направлении до достижения состояния равновесия. Ответ на этот вопрос дает второй закон термодинамики, на основе которого определены критерии возможности протекания процессов и их направления.
Процессы, которые совершаются в системе без внешнего воздействия окружающей среды, называются самопроизвольными, или положительными. Примерами самопроизвольных процессов являются переход теплоты от горячего тела к холодному, превращение работы в теплоту диффузия вещества из области большей концентрации в область меньшей концентрации.
Процессы, которые не могут происходить без внешнего воздействия, называются несамопроизвольными, или отрицательными. Примерами их являются переход теплоты от холодного тела к горячему, превращение теплоты в работу, диффузия из области с меньшей концентрацией в область с большей концентрацией вещества.
В изолированной системе ввиду отсутствия внешнего воздействия, могут происходить только самопроизвольные процессы. Они завершаются достижением состояния равновесия, из которого система не может выйти сама, без сообщения ей энергии извне.
Все процессы можно разделить на обратимые и необратимые. Необратимыми называют такие процессы, после протекания которых систему и окружающую среду одновременно нельзя вернуть в прежнее состояние.Если мы все-таки попытаемся вернуть систему в первоначальное состояние, то в окружающей среде обязательно произойдут какие-либо изменения. Все самопроизвольные процессы термодинамически необратимы.
Обратимыми называются такие процессы, после которых можно вернуть в первоначальное состояние одновременно и систему, и окружающую среду.При этом в обратном процессе система проходит через те же промежуточные состояния, что и в прямом процессе, только в обратном порядке. Обратимые процессы на практике неосуществимы. Это идеальное понятие.
 Обратимость и необратимость процесса определяется условиями его проведения. Приведем пример. В вакуумированной камере находится сосуд с газом. Если открыть сосуд, газ расширится, заполнив объем камеры. Это необратимый процесс, т.к. вернуть газ в первоначальное, сжатое в сосуде, состояние, можно только совершив работу за счет внешних сил, т.е. за счет изменения энергии окружающей среды. Для того, чтобы процесс расширения газа провести обратимо, представим себе такую идеальную систему. Газ, находящийся под нагруженным поршнем, работающим без трения. Уменьшая давление на поршень в каждый момент времени на бесконечно малую величину, будем расширять газ. Перемещая поршень, расширяющийся газ совершает при этом работу. Если совершаемая при расширении работа аккумулируется, например, сжимаемой пружиной, то возможна обратная работа, равная ей по величине, но противоположная по знаку: сжатие газа под поршнем разжимаемой пружиной.
Обратимость и необратимость процесса определяется условиями его проведения. Приведем пример. В вакуумированной камере находится сосуд с газом. Если открыть сосуд, газ расширится, заполнив объем камеры. Это необратимый процесс, т.к. вернуть газ в первоначальное, сжатое в сосуде, состояние, можно только совершив работу за счет внешних сил, т.е. за счет изменения энергии окружающей среды. Для того, чтобы процесс расширения газа провести обратимо, представим себе такую идеальную систему. Газ, находящийся под нагруженным поршнем, работающим без трения. Уменьшая давление на поршень в каждый момент времени на бесконечно малую величину, будем расширять газ. Перемещая поршень, расширяющийся газ совершает при этом работу. Если совершаемая при расширении работа аккумулируется, например, сжимаемой пружиной, то возможна обратная работа, равная ей по величине, но противоположная по знаку: сжатие газа под поршнем разжимаемой пружиной.
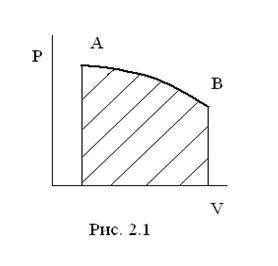
Представим себе, что процесс расширения газа происходит бесконечно медленно, каждый раз давление меняется на бесконечно малую величину. Тогда в каждый момент времени система будет бесконечно близка к равновесию. Работа такого процесса будет равна площади под кривой АВ (рис. 2.1):
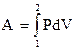 (2.1)
(2.1)
| |
|
Если процесс проходит через состояния, бесконечно близкие к равновесию, то такой процесс называется равновесным. Равновесные процессы протекают бесконечно медленно. Работа равновесного процесса Аравн > Анеравн и Аравн = Аmax. Реальные процессы всегда неравновесны.
Самопроизвольные необратимые процессы всегда протекают в направлении, приближающем систему к состоянию равновесия.
| <== предыдущая страница | | | следующая страница ==> |
| Влияние температуры на тепловые эффекты различных процессов. Закон Кирхгофа | | | Второй закон термодинамики |
Дата добавления: 2014-10-02; просмотров: 326; Нарушение авторских прав

Мы поможем в написании ваших работ!