
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Второй закон термодинамики
Как показывает опыт, для полного описания термодинамического процесса недостаточно первого закона термодинамики. Постулируя закон перехода одного вида энергии в другой, он не дает представления о возможности осуществления процесса в данных условиях. Критерии направления процесса и достижения состояния равновесия выводятся из второго закона термодинамики.
Второй закон термодинамики, как и первый, является постулатом. Но, в отличие от первого, второй закон термодинамики не является всеобъемлющим и неограниченным. Он применим лишь к макросистемам, имеющим ограниченные размеры, но состоящим из бесконечно большого числа частиц или микросостояний, т.к. направление самопроизвольного процесса определяется вторым законом термодинамики как переход системы от менее вероятного к более вероятному состоянию. А отклонения поведения системы от второго закона термодинамики тем более возможны, чем меньше частиц содержится в данной системе.
Таким образом, второй закон термодинамики носит статистический, то есть вероятностный характер. В качестве меры термодинамической вероятности состояния системы во втором законе термодинамики используется энтропия S.
В соответствии с уравнением Л.Больцмана, величина энтропии связана с термодинамической вероятностью состояния системы w:
S= k lnw + C, (2.2)
где k = R/Nа = 1,38×10-23 Дж/ град - постоянная Больцмана;
w - термодинамическая вероятность состояния системы;
С - константа интегрирования, величина неизвестная. По этой причине невозможно вычислить и абсолютные значения энтропии. Чем больше неупорядоченность, хаотичность расположения частиц в системе, тем больше термодинамическая вероятность состояния системы или процесса достижения данного состояния и тем больше энтропия.
Все известные формулировки второго закона термодинамики приводят к выводу о существовании у термодинамических систем новой функции состояния, которая изменяется при передаче системе теплоты и имеет разные значения для разных процессов, характеризуя, таким образом, их неоднозначность, разную вероятность. Этой функцией состояния и является энтропия. В некоторых учебниках утверждение о существовании энтропии и связи ее с теплотой иллюстрируется принципом Каратеодори, называемым принципом адиабатической недостижимости некоторых состояний.
Объединенное выражение второго закона термодинамики для обратимых (знак “=”) и необратимых (знак “<”) процессов имеет вид:
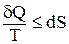 (2.3)
(2.3)
или в интегральной форме:
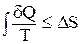 (2.4)
(2.4)
Величина Q/T (или dQ/T) называется приведенной теплотой. Обоснование этого уравнения достаточно подробно рассматривается в курсе физики и дается на примере анализа процессов, происходящих в тепловых машинах, работающих по циклу Карно.
Эта формула (2.3) является наиболее общим количественным выражением второго начала термодинамики. Она относится не только к любым круговым циклам, но и к незамкнутым процессам.
Вспомнив, таким образом, известные нам сведения о втором начале термодинамики, рассмотрим далее приложение его к анализу различных физико-химических процессов.
В физической химии критериями направления процесса и состояния равновесия в системе служат термодинамические потенциалы. Их обоснование выводится из второго начала термодинамики. Обратимся сначала к изолированным системам.
| <== предыдущая страница | | | следующая страница ==> |
| Основные термодинамические понятия | | | Энтропия как критерий самопроизвольности процесса и равновесия в изолированной системе. Изменение энтропии в различных процессах |
Дата добавления: 2014-10-02; просмотров: 343; Нарушение авторских прав

Мы поможем в написании ваших работ!