
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Энтропия как критерий самопроизвольности процесса и равновесия в изолированной системе. Изменение энтропии в различных процессах
В изолированной системе при протекании процесса dQ = 0; U = const и V = const, т.е. не происходит теплообмена с окружающей средой, а внутренняя энергия и объем системы постоянны.
В указанных условиях выражение второго закона термодинамики (2.3.) принимает вид:
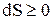 (2.5)
(2.5)
Поскольку энтропия является функцией состояния системы, то в интегральной форме:
S2 - S1 ³ 0 или
S2 ³ S1 (2.6)
Из выражения (2.6) следует, что в изолированной системе самопроизвольно будет протекать только такой процесс, в ходе которого энтропия системы возрастает (S2 > S1). Когда в результате процесса изолированная система придет в состояние равновесия при рассматриваемых условиях, энтропия достигнет максимума. То есть критерием равновесия в изолированной системе будет:
dS = 0 (2.7)
Если в изолированной системе протекает только обратимый (равновесный) процесс, то энтропия системы сохраняет постоянное значение.
Для неизолированных систем (открытых и закрытых) изменение энтропии DS может быть больше нуля или меньше нуля, т.е. эти критерии не имеют силы. Критерием направления процесса и состояния равновесия будет изменение других функций состояния.
Энтропия - это экстенсивное свойство системы, т.е. она пропорциональна массе. Общая энтропия системы равна сумме энтропий ее составных частей:
Sобщ = 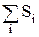 = S1+S2... (2.8)
= S1+S2... (2.8)
Размерность энтропии:
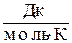 или
или 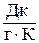
С целью сравнения и расчетов энтропии веществ относят к стандартному состоянию и обозначают  (нижний индекс означает температуру, принятую в термодинамике в качестве стандартной, в шкале Кельвина).
(нижний индекс означает температуру, принятую в термодинамике в качестве стандартной, в шкале Кельвина).
Рассмотрим расчет изменения энтропии в ряде равновесных процессов.
1. Стандартное изменение энтропии в результате химической реакции.
 (2.9)
(2.9)
где  - стандартные энтропии продуктов реакции и исходных веществ. Абсолютные значения энтропий веществ рассчитываются в соответствии с третьим началом термодинамики, (см. раздел 2.4). Их значения приводятся в справочной литературе.
- стандартные энтропии продуктов реакции и исходных веществ. Абсолютные значения энтропий веществ рассчитываются в соответствии с третьим началом термодинамики, (см. раздел 2.4). Их значения приводятся в справочной литературе.
2. В соответствии со вторым началом термодинамики, в любой изолированной системе изменение энтропии в изотермическом неравновесном процессе равно приведенной теплоте:
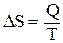 (*)
(*)
Пользуясь этим уравнением, рассчитывают изменение энтропии в процессе фазового превращения вещества (плавления, испарения, возгонки):
 (2.10)
(2.10)
где  - теплота фазового перехода; Тф.п. - абсолютная температура фазового перехода.
- теплота фазового перехода; Тф.п. - абсолютная температура фазового перехода.
Поскольку упорядоченность расположения частиц максимальна в твердом теле, то в процессе плавления энтропия возрастает.
Еще большее возрастание энтропии наблюдается при переходе жидкости в пар.
3. Нагревание “n” моль вещества от T1 до T2.
а) изохорный процесс, V=const:
 (2.11)
(2.11)
если CV = const в интервале T1 ¸ T2, то
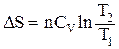 (2.12)
(2.12)
б) аналогично получим для изобарного процесса, P= const:
 (2.13)
(2.13)
Если мольные теплоемкости веществ Сv и Cp зависят от температуры (1.48), (1.49), то в уравнение (2.11) подставляют эти функции, решая интегралы аналогично уравнению Кирхгофа (1.63), (1.64).
В приведенных расчетах мы использовали второй закон термодинамики для обратимых (равновесных) процессов и учитывали только знак “=”.
Как же рассчитать изменение энтропии в неравновесном процессе? Так как изменение энтропии не зависит от пути и характера процесса (функция состояния системы), то
DSнеравн.=DSравн. (2.14)
и расчет DSнеравн. ведут по формулам для равновесных (обратимых) процессов, помня при этом, что приведенные теплоты обратимых и необратимых процессов отличаются, и
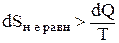 (2.15)
(2.15)
Рассмотрим пример.Найти изменение энтропии при нагревании одного моля алюминия от 298 до 873 К. Истинная молярная теплоёмкость кристаллического алюминия выражается уравнением:
СР = 20,67 + 12,39·10-3 Т, Дж/(моль·К).
Решение. В соответствии с уравнением (2.11), записанным для условий постоянства давления:

При нагревании одного моля алюминия энтропия повысится на 29,34 Дж/К.
2.4. Третий закон термодинамики. Постулат Планка
Для вычисления абсолютного значения энтропии системы в каком либо состоянии необходимо знать величину энтропии в исходном состоянии. Если исходным принять состояние при температуре абсолютного нуля, то
 или (2.16)
или (2.16)
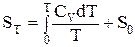 (2.17)
(2.17)
Величина S0 неизвестна. Однако, как выяснилось из серии опытов, при понижении температуры в областях, близких к 0°К, тепловые свойства всех веществ нивелируются, уменьшаются и выравниваются их теплоемкости, коэффициенты линейного расширения и др. В.Г. Нернст обобщил эти данные, сформулировав их в следующем виде:
При температуре, стремящейся к абсолютному нулю, изменение энтропии в изотермических процессах тоже стремится к нулю:
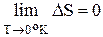 (2.18)
(2.18)
Этот вывод был назван тепловой теоремой Нернста или III началом ( законом) термодинамики(1906 г.)
Из теоремы Нернста следует, что при убывании температур энтропия должна достигать какого-то предельного значения S0. В 1911 г. М.Планк предположил, что этот предел изменения энтропии при понижении температуры до абсолютного нуля одинаков для всех веществ и равен нулевому значению энтропии:
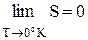 (2.19)
(2.19)
Это утверждение носит название “постулат Планка”. Наиболее упорядоченной структурой при Р = 1 атм и Т = 0 является идеальный кристалл. Постулат Планка утверждает, что энтропия идеального кристалла индивидуального вещества при абсолютном нуле равна нулю. Это дает возможность вычислить при любой температуре абсолютную энтропию вещества, т.к. определяет начальную точку отсчета: S0 = 0 при Т = 0.
По формулам (2.16) и (2.17) рассчитаны и табулированы стандартные энтропии различных веществ 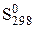 . При расчете энтропий в различных агрегатных состояниях в формулы (2.16) и (2.17) добавляются энтропии фазовых переходов (см. параграф 2.3).
. При расчете энтропий в различных агрегатных состояниях в формулы (2.16) и (2.17) добавляются энтропии фазовых переходов (см. параграф 2.3).
Поскольку, согласно постулату Планка, при Т®0 S®0, то 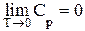 , т.е. при Т = 0 Ср = 0 и никакие процессы не могут снизить температуру до абсолютного нуля. Это принцип недостижимости абсолютного нуля. На практике в настоящее время достигнута температура около 0,00001 К.
, т.е. при Т = 0 Ср = 0 и никакие процессы не могут снизить температуру до абсолютного нуля. Это принцип недостижимости абсолютного нуля. На практике в настоящее время достигнута температура около 0,00001 К.
| <== предыдущая страница | | | следующая страница ==> |
| Второй закон термодинамики | | | Влияние давления на энтропию. Гипотеза Капустинского о состоянии вещества в глубинных зонах Земли |
Дата добавления: 2014-10-02; просмотров: 930; Нарушение авторских прав

Мы поможем в написании ваших работ!