
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Теплоемкость
|
Читайте также: |
Теплоемкостью системы C называется отношение бесконечно малого количества теплоты dQ, полученного системой, к соответствующему приращению dT ее температуры:
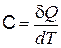 .
.
Если теплоемкость системы, состоящей из однородного вещества разделить на его массу m, получится удельная теплоемкость. Ее обычно обозначают малой буквой с (с = С/m). В термодинамике более удобно использовать теплоемкость одного моля вещества - молярную теплоемкость С:
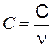 .
.
Количество тепла, получаемое молем однородного вещества в каком-либо бесконечно малом процессе, можно представить в виде:
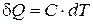 . (4.1)
. (4.1)
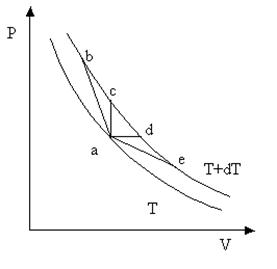 Рис. 4.1
Рис. 4.1
|
Как видно из рис. 4.1, на котором изображены две изотермы с температурами Т и Т + dT, приращение температуры dT еще не определяет полностью того состояния, в которое переходит система в результате процесса. Приращение объемов в процессах a-b, a-c, a-d, a-e различается как по величине, так и по знаку. В этих процессах будут совершены разные работы, и получены разные количества тепла. Поэтому теплоемкость в первую очередь зависит от происходящего в системе процесса. Свойствами вещества определяется теплоемкость только вполне определенного процесса, а не теплоемкость «вообще».
Запишем первое начало термодинамики (3.3) для одного моля однородного и изотропного вещества, выразив dQ через теплоемкость
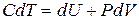 . (4.2)
. (4.2)
Рассматривая внутреннюю энергию как функцию температуры и объема U = U(T,V), возьмем ее полный дифференциал и подставим в (4.2)
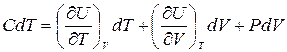 .
.
Разделив на dT, получим
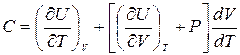 . (4.3)
. (4.3)
Объем зависит не только от температуры Т, но и от давления Р. В зависимости от происходящего с системой процесса, отношение dV/dT может принять любое значение. Поэтому и теплоемкость С, вообще говоря, может принимать любые значения от -¥ до +¥. В частности, для изотермического процесса С = ±¥, т.к. в этом случае dT = 0, dQ ¹ 0. При адиабатическом процессе dQ = 0, dT ¹ 0, С=0. Чтобы придать выражению (4.3) однозначный смысл, надо задать процесс.
Особенно важны теплоемкости при постоянном объеме и постоянном давлении, обозначаемые CV и СР. Если объем остается постоянным, то dV=0 и, следовательно,
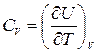 . (4.4)
. (4.4)
Если постоянно давление, то отношение dV/dT переходит в частную производную (¶V/¶T)P. В этом случае
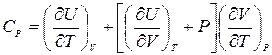 . (4.5)
. (4.5)
Разность теплоемкостей СР – CV равна
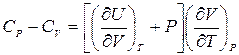 . (4.6)
. (4.6)
Если ввести новую функцию состояния Н, называемую энтальпией
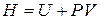 , (4.7)
, (4.7)
то ее дифференциал dH = dU + PdV + VdP в изобарическом (dP=0) процессе, как видно из соотношения (3.3), будет равен dQ. Тогда
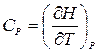 . (4.7)
. (4.7)
Как мы увидим в дальнейшем, теплоемкости CV и CP входят во многие термодинамические соотношения.
| <== предыдущая страница | | | следующая страница ==> |
| Первое начало термодинамики | | | Первое начало термодинамики для идеальных газов |
Дата добавления: 2014-08-09; просмотров: 409; Нарушение авторских прав

Мы поможем в написании ваших работ!