
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Применение первого закона термодинамики к различным процессам. Закон Гесса
ГЛАВА 1. Первый закон термодинамики. Термохимия
Основные понятия и определения
В термодинамике для правильного описания процесса очень важное значение имеет правильность применения той или иной терминологии, многочисленных термодинамических понятий. Поэтому необходимо с самого начала четко определить основные термины и понятия термодинамики. Мы будем пользоваться ими на протяжении всего курса физической химии.
Термодинамика - это наука, изучающая взаимные превращения различных видов энергии в зависимости от условий протекания процесса, а также возможность, направление и пределы самопроизвольного протекания процесса в рассматриваемых условиях. Она опирается на три фундаментальных закона, или начала, которые являются результатом обобщения практического опыта.
Химическая термодинамика - это та часть термодинамики, которая рассматривает применение законов термодинамики к химическим процессам и фазовым превращениям.
Система - в термодинамике системой называют тело или группу тел, состоящих из большого числа частиц и мысленно обособленных от окружающей среды. В зависимости от рассматриваемого явления система может быть различных размеров, но состоять она должна обязательно из большого числа частиц, так как только к макросистемам применимы такие понятия, как температура, давление, теплота и некоторые другие.
В зависимости от характера взаимодействия систем с окружающей средой их подразделяют на открытые, закрытые и изолированные.
Открытой называется система, которая может обмениваться с окружающей средой веществом и энергией.
Закрытой называется система, которая не обменивается с окружающей средой веществом, но она может обмениваться с ней энергией.
Изолированной называется система, объем которой остается постоянным и которая не обменивается с окружающей средой ни веществом, ни энергией. То есть исключается любое взаимодействие с окружающей средой. На практике абсолютная, полная изоляция системы от взаимодействия с окружающей средой не достижима. Понятие “изолированная система” - есть понятие идеальное (абстрактное), хотя на практике при определенных условиях этот термин применяют к реальным системам при термодинамических расчетах.
Адиабатически изолированная система - это система, в которой отсутствует теплообмен с окружающей средой.
Фаза - это часть системы с присущим ей химическим составом и макроскопическими свойствами. Иногда фазу определяют как часть системы, отделенную от других частей поверхностью раздела и механически отделимую от них. Это определение правильно, но только для непрерывных фаз. Если фаза прерывна (например, капли ртути на твердой поверхности), то второе определение не подходит. Все капли ртути в этом случае составляют одну фазу.
Гомогенной называется система, состоящая из одной фазы.
Гетерогенная - это система, состоящая из двух и более фаз.
Компонентами называются вещества, входящие в состав фаз.
Состояние системы - это совокупность физических и химических свойств, характеризующих систему.
Термодинамическими свойствами системы называют такие свойства, которые могут быть однозначно выражены через функции температуры, давления и концентрации веществ системы (это теплоемкость, внутренняя энергия, энтропия и т.п.). Термодинамические свойства системы взаимосвязаны. Изменение одного приводит к изменению остальных.
Для полного описания состояния системы достаточно знать некоторое наименьшее число термодинамических свойств, которые являются внутренними параметрами системами, это параметры состояния системы(температура, давление, объем, концентрации компонентов). Они связаны между собой уравнением состояния.
В общем виде уравнение состояния может быть записано следующим образом:
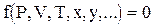 (1.1)
(1.1)
где P, V, T, x, y - параметры состояния.
В качестве известного примера можно привести уравнение состояния “n” молей идеального газа, т.е. уравнение Менделеева - Клапейрона:
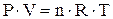 (1.2)
(1.2)
Все свойства системы можно разделить на две группы:
* интенсивные - не зависящие от массы (это температура, давление, молярная теплоемкость, молярный объем) и
* экстенсивные- пропорциональные массе системы (это объем, энтропия, внутренняя энергия, теплоемкость системы).
Если в системе изменяется во времени хотя бы одно из термодинамических свойств, значит в системе протекает термодинамический процесс.
Если в ходе процесса изменяется химический состав системы, то процесс называют химической реакцией.
Все процессы делят на самопроизвольные (не требующие затрат энергии извне) и несамопроизвольные - требующие для своего протекания затраты энергии.
Протекание самопроизвольного процесса в конечном итоге приводит систему в состояние равновесия - это один из постулатов термодинамики. В состоянии равновесия свойства системы не меняются. Из состояния равновесия система может выйти только при внешнем воздействии.
Процесс, при котором система, выйдя из какого-то начального состояния и претерпев ряд изменений, возвратилась в это начальное состояние, называется круговым процессомилициклом. В круговом процессе изменение любого параметра равно нулю.
Функцией состояния называется такой параметр, изменение которого в ходе процесса зависит только от начального и конечного состояния системы и не зависит от пути процесса.
1.2. Внутренняя энергия, теплота и работа. Первый закон термодинамики
Неотъемлемым свойством материи является движение. Мерой движения является энергия. Важным термодинамическим свойством системы является ее внутренняя энергия.
Внутренняя энергия - это общий запас энергии системы за вычетом кинетической энергии системы в целом и ее потенциальной энергии положения.С позиций молекулярно-кинетической теории физический смысл внутренней энергии определяется следующим образом. Это совокупность всех видов энергии частиц в системе, т.е. сумма энергий поступательного, колебательного, вращательного движения молекул, энергия взаимодействия между молекулами, энергия связей атомов в молекуле, энергия электронов, ядер атомов и т.д. Внутренняя энергия системы зависит от природы вещества, его массы и от параметров состояния системы. Абсолютная величина внутренней энергии любой системы неизвестна, но в химической термодинамике достаточно знать только изменение внутренней энергии в ходе процесса. Размерность внутренней энергии (“U”) Дж или Дж/моль.
Внутреннюю энергию системы можно увеличить двумя путями:
- совершив какую-либо работу над системой;
- сообщив системе какое-то количество теплоты.
(Чтобы уменьшить внутреннюю энергию, работа должна быть совершена системой, а теплота - из системы выделиться).
Таким образом, теплота и работа характеризуют качественно и количественно две формы передачи энергии от одного тела к другому. В первом случае передача энергии происходит за счет перемещения масс, состоящих из большого числа частиц под действием каких-либо сил (работа). Во втором случае передача энергии происходит за счет хаотического столкновения молекул двух соприкасающихся тел (теплота). Во многих процессах изменение внутренней энергии осуществляется частично за счет передачи тепла и частично за счет совершения работы. Теплота (Q) и работа (А) имеют ту же размерность, что и внутренняя энергия. Бесконечно малые количества теплоты и работы обозначают: dQ и dА.
Теплота, полученная системой, считается положительной (dQ > 0), это эндотермическийпроцесс, отданная системой - отрицательна (dQ < 0), это экзотермическийпроцесс. Работа, совершаемая системой против внешних сил, считается положительной (dА > 0); работа, совершаемая над системой - отрицательна (dА < 0).
Работа всегда может быть выражена как произведение обобщенной силы на изменение обобщенной координаты:
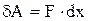 (1.3)
(1.3)
Например, работа расширения идеального газа:
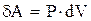 (1.4)
(1.4)
Сила - есть фактор интенсивности.
Координата - фактор экстенсивности (или емкости).
Аналогично этому теплота тоже может быть выражена как произведение постоянной величины фактора интенсивности (Т) на изменение фактора емкости (энтропия S):
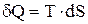 (1.5)
(1.5)
.
Взаимосвязь между внутренней энергией, теплотой и работой устанавливается на основе первого закона (начала) термодинамики. Он является постулатом, вытекающим из опыта, и представляет собой одну из форм закона сохранения энергии, установленного в современном виде Гессом (1840), Майером (1842), Джоулем (1842) и Гельмгольцем (1847).
Существует ряд формулировок первого закона термодинамики, которые равноценны и вытекают одна из другой. Приведем некоторые из них.
* “В любой изолированной системе общий запас энергии остается постоянным”.
* “Разные формы энергии переходят друг в друга в строго эквивалентных количествах”.
* “Вечный двигатель первого рода невозможен, т.е. невозможно построить машину, которая производила бы механическую работу, не затрачивая на это эквивалентного количества внутренней энергии”.
Математическая формулировка первого закона термодинамики:
δQ=dU+δA, (1.6)
т.е. теплота, сообщенная системе, расходуется на приращение внутренней энергии и на совершение системой работы.
В интегральной форме:
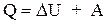 (1.7)
(1.7)
“А” - это сумма всех видов работ, совершаемых системой. Она может быть представлена как сумма двух слагаемых: полезная работа А´., т.е. работа за счет химических, электрических и других подобных сил и работа расширения.
Для многих систем работа расширения является единственным видом работ.
Работа расширения идеального газа:
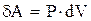 (1.8)
(1.8)
или в интегральной форме:
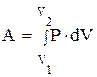 (1.9)
(1.9)
В изобарном процессе (Р = const):
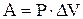 (1.10)
(1.10)
С учетом этого для процессов, единственным видом работы в которых является работа расширения, I закон термодинамики запишется таким образом:
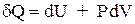 (1.11)
(1.11)
или
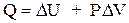 (1.12)
(1.12)
Бесконечно малые количества теплоты и работы мы обозначаем значком d - частный дифференциал, а для внутренней энергии применяем значок d - полного дифференциала.
Эта запись имеет большой физический смысл. Рассмотрим два состояния изолированной системы: состояние 1 и состояние 2. В каждом из них система имеет определенные значения параметров P, T, V и т.д. Меняя эти параметры, переведем систему из состояния 1 в состояние 2 по пути l1, а затем вернем ее из состояния 2 в состояние 1 другим путем - l2 (рис. 1.1).
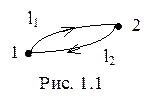
|
Такой процесс, как мы уже знаем, называется циклом, или круговым процессом.
Изменение внутренней энергии в круговом процессе равно нулю. Это следует из закона сохранения энергии. В противном случае можно было бы, вернувшись в исходное состояние, получить выигрыш энергии из ничего или бесследно ее потерять. Отсюда следует, что внутренняя энергия является функцией состояния системы, т.е. ее изменение не зависит от пути процесcа, а зависит только от начального и конечного состояния системы, и интеграл по замкнутому контуру
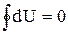 (1.13)
(1.13)
Из математики нам известно, что если интеграл по замкнутому контуру от некоторого подинтегрального выражения равен нулю, то это подинтегральное выражение является полным дифференциалом некоторой функции. Поэтому бесконечно малое приращение внутренней энергии есть полный дифференциал: dU.
Теплота и работа (по отдельности) в круговом процессе не равны нулю, они не являются функциями состояния системы, т.е. зависят от пути процесса. Их бесконечно малые приращения не являются полными дифференциалами и обозначаются dQ и dA. Таким образом, теплота и работа являются характеристиками процесса, а внутренняя энергия - есть принадлежность, характеристика состояния системы.
Применение первого закона термодинамики к различным процессам. Закон Гесса
Если единственным видом работы, совершаемой системой, является работа расширения идеального газа, то первый закон термодинамики описывается уже известным нам уравнением:
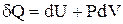 (1.14)
(1.14)
При изохорно-изотермическом процессе V=const и dV=0, тогда
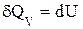 и
и 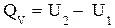 или
или
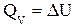 (1.15)
(1.15)
При изобарно-изотермическом процессе Р=const, и при интегрировании уравнения (1.14) величину Р можно выносить за знак интеграла:
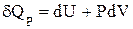 ; (*)
; (*)
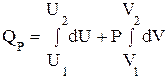 (*)
(*)
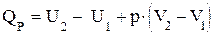 или (1.16)
или (1.16)
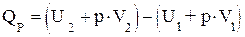 (1.17)
(1.17)
Введем новое обозначение функции (U + p×V):
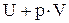 = Н (1.18)
= Н (1.18)
и подставим его в уравнение 1.16:
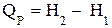 или
или
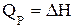 , (1.19)
, (1.19)
а для элементарного процесса
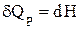 (1.20)
(1.20)
Термодинамическая функция “Н” называется энтальпией. Она имеет важное значение в химической термодинамике. Физический смысл энтальпии можно представить, объединив уравнения 1.16 и 1.19:
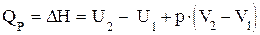 или
или
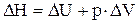 (1.21)
(1.21)
Из уравнения (1.21) видно, что изменение энтальпии включает в себя изменение внутренней энергии DU и энергию, расходуемую на расширение системы. Таким образом, энтальпия может рассматриваться как энергия расширенной системы. Энтальпия, так же как и внутренняя энергия, является функцией состояния системы. Отсюда вытекает весьма важный для практики вывод: в изобарном и изохорном процессах тепловой эффект процесса приобретает свойства функции состояния системы, т.е. не зависит от пути процесса (его промежуточных стадий), а определяется только начальным и конечным состоянием системы.
Это положение было сформулировано на основе обобщения опытных данных в 1836 году профессором Петербургского горного университета Германом Ивановичем Гессом и называется законом Гесса. Герман Гесс (1802-1850) открыл и химически изучил уваровит, гидроборацит и многие другие минералы. Разработал методы химического обогащения различных руд, изучал состав природных горючих газов и некоторых нефтей. В честь него назван теллурид серебра – минерал гессит.
Закон Гесса, как показано выше, является математическим следствием первого закона термодинамики.
Для реакций в конденсированных фазах (твердых и жидких), объем которых почти не меняется, DH практически не отличается от DU. Для этих условий справедливы равенства:
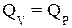 и
и 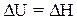 (1.22)
(1.22)
Для химической реакции, идущей с изменением числа молей газообразных веществ Dn, взаимосвязь тепловых эффектов изобарного и изохорного процессов (DH и DU) можно, с учетом уравнения Клапейрона-Менделеева:
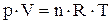 , (1.23)
, (1.23)
записать следующим образом:
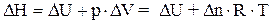 , ( 1.24)
, ( 1.24)
где R – универсальная газовая постоянная,
Т – абсолютная температура.
Если реакция идет без изменения числа молей газообразных веществ, то Dn в уравнении (1.24) равно нулю и DH = DU.
До сих пор, рассматривая первый закон термодинамики, мы имели в виду закрытые системы. Обратимся теперь к открытым системам.
Каждый компонент, привносимый в систему, служит дополнительным источником энергии, поскольку каждое вещество обладает каким-то своим определенным запасом внутренней энергии. Поэтому, для любого процесса, идущего в открытой системе, с изменением числа молей вещества, в выражение первого начала вводят еще одно слагаемое, учитывающее изменение внутренней энергии системы в виде произведения midni. Здесь dni – изменение числа молей вещества i, mi – количество энергии, отвечающее одному молю вещества i. Для всей суммы веществ переменной массы это Smidni. Тогда запись первого закона термодинамики для открытых систем будет иметь вид:
δQ + Σμidn i= dU + δA (1.25)
Далее, рассматривая законы термодинамики, мы будем в основном иметь в виду закрытые системы.
| <== предыдущая страница | | | следующая страница ==> |
| ГЛАВА 9. РАСЧЕТЫ ВОДОЗАБОРОВ В УСЛОВИЯХ ЗАКРЫТЫХ СТРУКТУР | | | Термохимия |
Дата добавления: 2014-10-02; просмотров: 1140; Нарушение авторских прав

Мы поможем в написании ваших работ!