
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Твердые растворы. Понятие об изоморфизме
В 1819 г. Э. Митчерлих установил, что твердые соединения сходной кристаллической структуры могут образовывать смешанные кристаллы, т.е. входить в элементарную ячейку другого компонента. Такие кристаллы Митчерлих назвал изоморфными, а способность к образованию смешанных кристаллов - изоморфизмом. Способность к изоморфизму в значительной мере определяется сходством размерных факторов (радиуса атомов и расстояния между ними в кристалле) и сходством типа кристалла. Это впервые установлено Д.И. Менделеевым, работы которого внесли большой вклад в изучение явления изоморфизма. В 1890 г. Вант-Гоффом введено новое название изоморфных смесей - твердые растворы. В настоящее время применяют оба термина. Благодаря появлению метода рентгеноструктурного анализа, основанного на изучении дифракции рентгеновских лучей кристаллами, было установлено, что следует различать три типа твердых растворов: замещения, внедрения и вычитания (рис. 4.12).
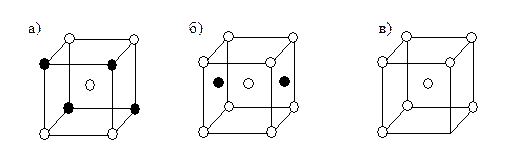
Рис. 4.12.Кристаллические решетки твердых растворов:
а) замещения; б) внедрения; в) вычитания
Твердые растворы замещения образуются путем замещения структурных единиц кристаллической решетки компонента - растворителя ионами, атомами или молекулами другого компонента, при этом тип решетки сохраняется. Обязательным условием изоморфизма является аналогия химического строения компонентов, равенство знаков зарядов ионов, сходство симметрии и размеров кристаллических ячеек.
В твердых растворах внедрения кристаллическая решетка образована компонентом-растворителем, а внедряющиеся атомы или ионы второго компонента размещаются между узлами кристаллической решетки. Такого типа твердые растворы образуются, например, при растворении неметаллов (С, H, N, B) в металлах; при внедрении натрия и алюминия в структуру SiO2 (b-кристобалит).
Твердые растворы вычитания являются результатом образования вакансий, незанятых мест в структуре кристаллической решетки. Например, минерал пирротин содержит избыточное количество серы по сравнению с тем, которое соответствует формуле вещества FeS. Отсутствие некоторого числа атомов железа в структуре минерала обнаружено рентгенографически. Состав пирротина меняется в пределах Fe6S7-Fe11S12.
Взаимная растворимость компонентов в твердом состоянии может быть неограниченной (непрерывные твердые растворы) и ограниченной. В последнем случае различают узкие твердые растворы (от нескольких процентов до нескольких сотых долей процентов растворенного вещества) и широкие (до нескольких десятков процентов).
Сплавы и минералы, образующие непрерывные и ограниченные твердые растворы, чрезвычайно распространены. Это, например, медь и золото, серебро и платина, медь и никель. Непрерывные твёрдые растворы образуют плагиоклазы, оливины.
4.8.1. Непрерывные твердые растворы
Рассмотрим фазовую диаграмму двухкомпонентной системы, образующей непрерывные твердые растворы, на примере плагиоклазов, рис. 4.13.
Плагиоклазы представляют собой кальциево-натриевые полевые шпаты различного состава. При этом состав минералов может непрерывно изменяться от чистого натриевого члена - NaAlSi3O8 (альбита), до чистого кальциевого члена - CaAl2Si2O8 (анортита).
Система NaAlSi3O8-CaAl2Si2O8 исследована впервые Боуэном в 1913 г. На диаграмме имеется линия ликвидуса - ALKB, характеризующая состав насыщенного расплава в зависимости от температуры и линия солидуса - AEFB, характеризующая состав твердого раствора. Выше линии ликвидуса - поле жидкой фазы, ниже линии солидуса поле твердой фазы.
Между кривыми ликвидуса и солидуса - область гетерогенного
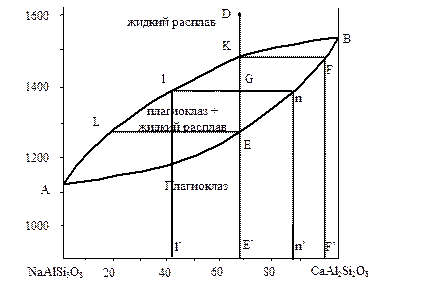
Рис. 4.13. Фазовая диаграмма двухкомпонентной системы
“альбит-анортит”, образующей непрерывные твердые растворы
равновесия жидких и твердых растворов. Так, точка G в этой области соответствует гетерогенной системе, состоящей из жидкого расплава состава l’ и плагиоклаза состава n’, находящихся в равновесии при данной температуре. Сравнение составов равновесных фаз показывает, что твердый раствор всегда обогащен более тугоплавким компонентом по сравнению с равновесным с ним жидким расплавом. Это правило является общим для гетерогенных систем с твердыми растворами. Оно называется первым правилом Гиббса-Розебома.
Составы и относительные количества сосуществующих жидкой и твердой фаз определяются по правилу рычага. Длина линии Gl пропорциональна количеству выделившихся кристаллов, а длина линии Gn - количеству оставшейся жидкости.
Ход кристаллизации в системах такого типа имеет характерную особенность. При охлаждении жидкости D до ликвидуса в точке К начинают появляться кристаллы состава F’. В кристаллах больше тугоплавкого компонента, чем в жидкости, равновесной с ними, поэтому жидкость обогащается компонентом NaAlSi3O8 и температура ее затвердевания снижается (по линии ликвидуса от точки K до точки L). В соответствии с этим меняется и состав твердой фазы (от точки F’ до точки E’), которая находится в равновесии с жидким расплавом. В то же время ранее выделившиеся кристаллы взаимодействуют с окружающим насыщенным расплавом, претерпевая при понижении температуры постепенные изменения состава от F’ до E’ уже в неравновесных условиях. Таким образом, по мере изменения состава жидкости от K к L вдоль линии ликвидуса, состав кристаллов (как равновесно образующихся при данных условиях, так и образовавшихся ранее), непрерывно изменяется от F к Е. Последняя порция расплава затвердевает в точке L, а состав кристаллов, образующихся при этом (в точке Е), аналогичен составу жидкого расплава D.
Вторичные взаимодействия, о которых сказано выше, между остывающим расплавом и ранее выделившимися кристаллами, обогащенными Са, медленны и могут идти не до конца. В результате образуются слоистые плагиоклазы с краевой зоной, содержащей альбита больше, чем в центральной части кристалла.
Некоторые твердые растворы характеризуются наличием экстремальной точки на диаграмме, в которой ликвидус и солидус соприкасаются. В точках экстремума составы равновесных твердой и жидкой фаз одинаковы (второе правило Гиббса-Розебома). Диаграммы с экстремумом приведены на рис. 4.14.
Непрерывные твердые растворы можно разделить на компоненты методом фракционной перекристаллизации. Так, например, разделяют на компоненты Ag и Au в промышленности (метод зонной плавки). Минерал электрум, представляющий собой твердый раствор Ag-Au с содержанием последнего 30-50% расплавляют, затем охлаждают до 1000°С. Кристаллизующийся твердый раствор обогащен тугоплавким золотом по сравнению с расплавом. Фазовая диаграмма системы Ag-Au подобна изображенной на рис. 4.13. Обогащенные золотом кристаллы отделяют и снова расплавляют. Второй раз охлаждают уже до 1025°С и получают кристаллы с еще большим содержанием золота и вновь отделяют их. Повторяя этот процесс многократно, получают почти чистое золото.
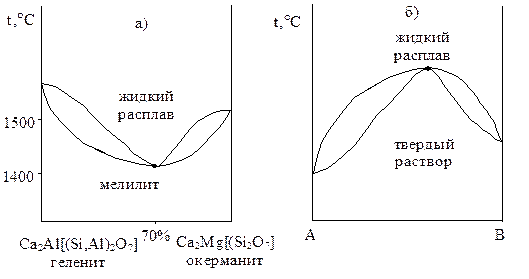
Рис. 4.14. Фазовые диаграммы экстремального типа с непрерывными твердыми растворами
Системы, характеризующиеся фазовыми диаграммами с экстремальными точками, не всегда можно разделить перекристаллизацией, поскольку в точках экстремума составы фаз одинаковы.
Поясним это на примере системы геленит-окерманит, рис. 4.14. Минимум на кривых солидуса и ликвидуса соответствует содержанию окерманита в минерале 70%. Твердые растворы с содержанием окерманита меньше 70% можно разделить перекристаллизацией на чистый гелинит и нераздельно кристаллизующийся твердый раствор экстремального состава (70% окерманита). Из растворов, содержащих больше 70% окерманита, можно выделить чистый окерманит, получая в остатке тот же твердый раствор с 70% окерманита.
Многие минералы и сплавы, образующие при высоких температурах твердые растворы, с понижением температуры распадаются на механические смеси. Поэтому в разных температурных интервалах системы могут описываться разными типами диаграмм. Например, система альбит (Ab) ортоклаз (Оr) при температурах выше 800°С образует твердый раствор с нижней экстремальной точкой, рис. 4.15. При температуре 660°С, образуемый ими твердый раствор санидин, распадается на две твердые фазы, представляющие собой механическую смесь двух ограниченных твердых растворов a и b (заштрихованная область). Состав равновесных фаз a и b при постоянной температуре находится по ноде, как показано на рисунке.
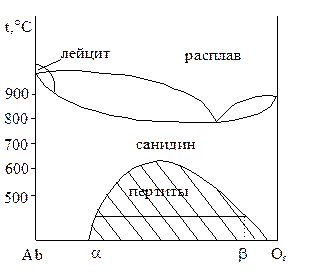
Рис. 4.15. Бинарная система альбит-ортоклаз с распадом
твердых растворов
4.8.2. Ограниченные твердые растворы
Существуют два типа диаграмм ограниченных твёрдых растворов: эвтектического и перитектического типов.
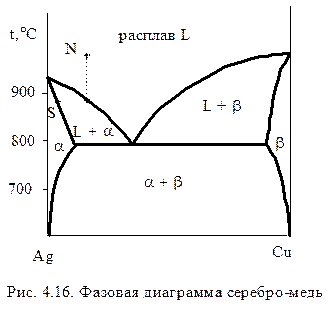
|
Эвтектическая диаграмма с областями ограниченной растворимости отличается от простой эвтектической (рис. 4.5) наличием полей ограниченных твердых растворов a и b. Например, a-твердый раствор меди в серебре и b-твердый раствор серебра в меди, рис. 4.16.
Снижение температуры от точки N на поле жидкого расплава до линии ликвидуса приводит к появлению твердого раствора a, состав которого определяется точкой S. При выборе начальной точки в заэвтектической области выделяются b-твердые растворы, состав которых определяется аналогично.
Ниже линии солидуса система представляет собой смесь твердых растворов a и b,состав которых находят по ноде (подобно тому, как показано на рис. 4.13). выоре начальной точки в заэвтектической области выделяются b-твердые растворы, состав которых определяется аналогично.
Перитектические фазовые диаграммы с областями ограниченной растворимости имеют более сложный вид. Поскольку в природе системы минералов такого типа широко распространены, рассмотрим в качестве примера фазовую диаграмму бинарной системы NaAlSiO4-NaAlSi3O8, рис. 4.17. Три заштрихованные области представляют собой поля твердых фаз. Это твердые растворы: нефелин, содержащий до 34% NaAlSi3O8; карнегиит, устойчивый в области высоких температур и альбит, образующий твердый раствор, содержащий до 4% NaAlSiO4.
Треугольник KEF представляет двухфазную область, в которой кристаллы карнегиита ассоциируются с кристаллами нефелина, несколько различающимися по содержанию компонента NaAlSi3O8.
Рассмотрим охлаждение расплава по изоплете, начинающейся в точке А, с содержанием NaAlSi3O8 40%. Жидкость данного состава охлаждается до ликвидуса в точке В, где начинается кристаллизация твердогораствора (карнегиита) состава С. В процессе охлаждения состав расплава меняется по линии ликвидуса до точки D, а состав сосуществующего с расплавом карнегиита меняется до точки Е. Ниже этой температуры
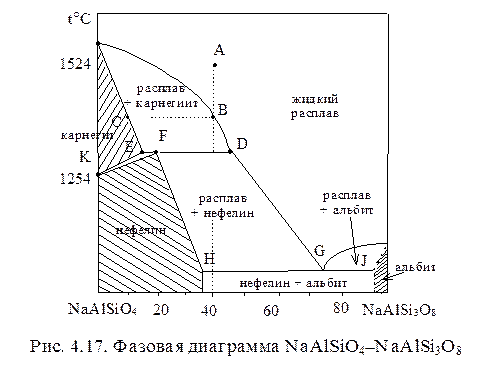
карнегиит такого состава существовать не может; при этой температуре в инвариантных условиях протекает реакция:
расплав (D) + карнегиит (Е) ® нефелин (F)
Часть расплава расходуется на реакцию, количество жидкости уменьшается. Температура вновь начинает падать, когда карнегиит полностью перейдет в нефелин. Состав расплава меняется от D до G, а состав нефелина - от K до H. При достижении эвтектического состава расплава (G), наряду с нефелином состава Н кристаллизуется альбит состава J. Система при этом инвариантна до полного затвердевания расплава. Далее температура смеси двух твердых фаз снова понижается, при этом составы твердых растворов существенно не меняются.
В данной главе рассмотрены основные физико-химические законы фазовых равновесий и основные типы фазовых диаграмм однокомпонентных и двухкомпонентных гетерогенных систем. Двойные системы с ограниченной растворимостью в жидком состоянии будут рассмотрены в разделе “Молекулярные растворы” учебного пособия. Фазовые диаграммы тройных и более сложных многокомпонентных конденсированных систем, представляющих интерес для материаловедов, геологов и петрологов, подробно освещены в специальной литературе по материаловедению, минералогии и петрографии. В списке литературы, приведенном в конце учебного пособия, имеется ряд ссылок на такие издания.
| <== предыдущая страница | | | следующая страница ==> |
| Фазовые диаграммы однокомпонентных гетерогенных систем | | | ГЛАВА 5. РАСТВОРЫ |
Дата добавления: 2014-10-02; просмотров: 563; Нарушение авторских прав

Мы поможем в написании ваших работ!