
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Определить абсолютные значения электродных потенциалов невозможно. Их можно только сравнивать
В качестве электрода сравнения используется так называемый водородный электрод (рис.2),потенциал которого при стандартных условиях
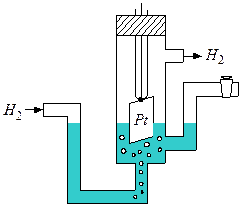
|
| Рис.2 Схема водородного электрода |
(р=101,325КПа; Т=298К; активность ионов в растворе 1моль/л) принят равным нулю. Газообразный водород не проводит электрического тока, но, адсорбируясь на платиновой поверхности в кислой среде, образует электрод, аналогичный металлическому. Водород в виде ионов переходит в раствор, и устанавливается равновесие
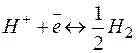 .
.
При измерении электродных потенциалов металлов составляют гальванический элемент из водородного электрода сравнения (анод) и исследуемого металлического электрода (катод) при стандартных условиях. Измеряемая в этом случае ЭДС гальванического элемента
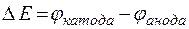 (
( 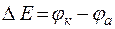 )
)
при 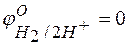 отвечает стандартному электродному потенциалу металла
отвечает стандартному электродному потенциалу металла 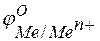 .
.
Стандартные электродные потенциалы металлов сведены в таблицу (ряд напряжений) (см. табл. 5). При значениях активностей, отличных от 1 моль/л, равновесные электродные потенциалы рассчитываются по уравнению Нернста:
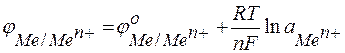 ,
,
где: аМеп+ – активность ионов металла в растворе;
R – универсальная газовая постоянная.
При небольших концентрациях растворов, применяемых в лабораториях, активность можно заменить концентрацией и после подстановки значений констант и параметров получить расчетное уравнение в виде
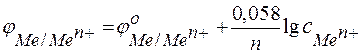 .
.
Зависимость электродных потенциалов от концентрации широко используют для определения многих важнейших констант: произведения растворимости, константы нестойкости, ионного произведения воды, рН водных растворов. Для этих целей используют концентрационные цепи, в которых материал электродов одинаков, а отличны лишь концентрации растворов электролитов, содержащих соответствующие катионы. Например:
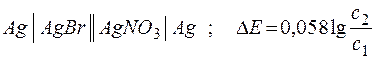 ;
;
с1 < с2 ; 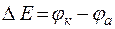 .
.
Можно построить совершенно аналогичную окислительно-восстановительную цепь с участием только ионов в каждом из процессов окисления и восстановления, при этом электроды инертные, а продукты реакции остаются в растворе и не выделяются на электродах. Например, в гальваническом элементе типа
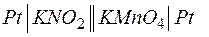
переход электронов осуществляется от электрода с KNO2 к электроду с KMnO4, о чем свидетельствует измеритель напряжения. Для того чтобы составить уравнение электродной реакции, можно воспользоваться электронно-ионным способом, включая в уравнение только участвующие в реакции ионы, которые образуются при диссоциации сильного электролита, и молекулы слабых электролитов, в том числе воды. Уравнивание следует производить путем прибавления или отнятия молекул воды (ионов ОН– или Н+ для щелочной или кислой среды соответственно).
В приведенном примере анодом будет электрод с NO2–, а катодом – электрод с MnO4– в водном растворе. Поэтому реакция окисления на аноде записывается в виде
NО2– + Н2О – 2е  NО3– + 2Н+,
NО3– + 2Н+,
реакция восстановления на катоде принимает вид
MnO4 – + 8Н+ + 5е  Mn2+ + 4 Н2О.
Mn2+ + 4 Н2О.
Суммирование обеих полуреакций с учетом баланса электронов дает уравнение реакции в ионном виде:
| 2 | MnO4 – + 8Н+ + 5е  Mn2+ + 4 Н2О Mn2+ + 4 Н2О
| |
| 5 | NО2– + Н2О – 2е  NО3– + 2Н+ NО3– + 2Н+
|
2MnO4 – + 6Н+ + 5NО2–  2Mn2+ + 3 Н2О + 5NО3–
2Mn2+ + 3 Н2О + 5NО3–
или в молекулярном виде:
5KNО2 + 2KMnO4 + 3Н2 SO4  5KNО3 + 2MnSO4 + K2SO4 + 3 Н2О
5KNО3 + 2MnSO4 + K2SO4 + 3 Н2О
Величина потенциала каждого электрода может быть определена его сравнением с водородным электродом. Так как окислительно-восстановительные потенциалы зависят от концентраций, то такое сравнение принято проводить при концентрациях окисленной и восстановленной форм, равных 1 моль/л. В таблице стандартных окислительно-восстановительных потенциалов приводятся только потенциалы восстановления (для окислителя):
| MnO4 – + 8Н+ + 5е® Mn2+ + 4Н2О; | 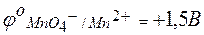
|
| NО2– + Н2О – 2е ® NО3– + 2Н+; | 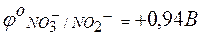
|
Электродная реакция, характеризующаяся меньшей величиной потенциала, определяет восстановитель и переписывается в обратном направлении; при этом знак потенциала меняется на обратный. Суммируя электродные потенциалы, можно определить величину ЭДС элемента, положительное значение которой подтверждает возможность самопроизвольного протекания реакции. По найденной величине  можно рассчитать
можно рассчитать  и по уравнению изотермы Вант-Гоффа определить константу равновесия К, величина которой однозначно характеризует глубину протекания процесса.
и по уравнению изотермы Вант-Гоффа определить константу равновесия К, величина которой однозначно характеризует глубину протекания процесса.
Зависимость восстановительного потенциала от концентрации ионов определяемая уравнением Нернста, а именно:
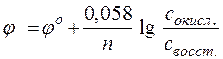
включает концентрацию тех ионов, которые написаны в уравнении электродной реакции, характеризуемой восстановительным потенциалом, после знака равенства (свосст) или перед знаком равенства (сокисл). Концентрации окисленных и восстановленных форм ставятся в степенях их стехиометрических коэффициентов. Так, для потенциала электродов в приведенном выше случае следует записать
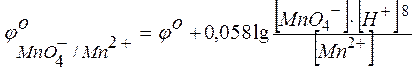 ;
;
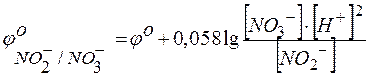 .
.
Окислительные свойства молекул или ионов тем сильнее, чем больше их потенциалы по алгебраической величине. Соотношения:
-nF 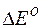 =
= 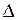 Go = – RT lnK =
Go = – RT lnK = 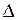 Ho – T
Ho – T 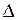 So
So
позволяют вычислить изменения свободной энергии 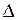 Go, энтальпии
Go, энтальпии 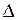 Ho, энтропии
Ho, энтропии 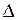 So и константу равновесия электрохимического процесса К по известным значениям Eo и T. Для этого достаточно знать равновесные ЭДС элементов хотя бы при двух температурах и решить систему из двух уравнений с двумя неизвестными.
So и константу равновесия электрохимического процесса К по известным значениям Eo и T. Для этого достаточно знать равновесные ЭДС элементов хотя бы при двух температурах и решить систему из двух уравнений с двумя неизвестными.
1.8.2. Электролиз
Электролизом называют окислительно-восстановительные реакции, протекающие на электродах при прохождении электрического тока через растворы или расплавы электролитов.
При электролизе электрод, соединенный с отрицательным полюсом внешнего источника постоянного тока, называется катодом (на нем идет восстановление), соединенный с положительным полюсом источника тока – анодом (на нем идет окисление).
В любом растворяемом в воде электролите под влиянием полярных молекул воды или под влиянием нагрева безводного электролита наблюдается процесс диссоциации его молекул на ионы. Поэтому при погружении в электролит электродов, соединенных с источником тока, происходит направленное перемещение ионов: катионов (положительно заряженных ионов) к катоду, анионов (отрицательно заряженных ионов) - к аноду. Например, при электролизе раствора или расплава хлорида натрия (NaCl) ионы Na+ перемещаются к катоду (К–), а ионы Cl- – к аноду(А+).
Различают растворимые и нерастворимые аноды. К первым относятся аноды, изготовленные из угля, графита или благородных металлов (золота, платины, палладия и т.п.). В этом случае к анодам перемещаются анионы кислотных остатков, и протекает соответствующий окислительный процесс. Например:
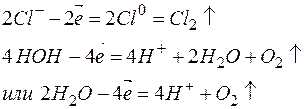
К растворимым анодам относятся аноды, изготовленные из любых металлов, кроме благородных. В этом случае происходит окисление (растворение) самого анода. Например, на медном аноде протекает следующий процесс:
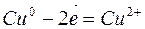
Для решения вопроса о составе полученных при электролизе продуктов необходимо учесть порядок восстановления катионов на катоде и анионов на аноде. Восстанавливающийся на катоде катион называется окислителем, окисляющийся анион – восстановителем.
Руководствуясь вторым началом термодинамики, таблицей стандартных электродных потенциалов металлов и ее свойствами, утверждающими, что окислительная способность катионов возрастает сверху вниз, а восстановительная способность атомов металлов – снизу вверх, в простейших случаях можно установить следующий порядок восстановления катионов на катоде.
В первую очередь восстанавливаются катионы металлов с наиболее положительными значениями стандартных электродных потенциалов (от золота до сурьмы включительно). Например:

Во вторую очередь преимущественно восстанавливаются катионы металлов, занимающих в ряду напряжений среднее положение (от вольфрама до марганца). Например:

Вместо всех остальных активных металлов, расположенных выше марганца, восстанавливаются молекулы воды с образованием на катоде газообразного водорода 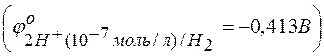 , что связано с большим перенапряжением восстановления указанных металлов:
, что связано с большим перенапряжением восстановления указанных металлов:
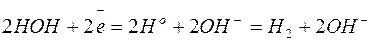
Пользуясь рядом стандартных окислительно-восстановительных потенциалов, можно приближённо установить порядок окисления анионов на аноде:
· В первую очередь окисляются анионы бескислородных кислот(S2-, I–, Br–, Cl–, CN–), за исключением иона фтора. Например:

· Во вторую очередь окисляются молекулы воды по уравнению: 
· В третью очередь окисляются анионы бескислородных кислот. Например: 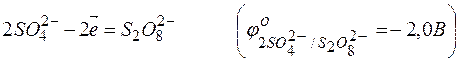
В случае растворимого анода происходит его окисление (см. выше). В случае протекания вышеперечисленных процессов по второму началу термодинамики система переходит в состояние с минимальным запасом энергии, т.е. её изобарно-изотермический потенциал 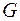 понижается
понижается 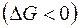 .
.
Рассмотрим примеры различных случаев электролиза.
Примеры электролиза растворов электролитов
с нерастворимыми анодами.
1. Электролиз раствора хлорида меди 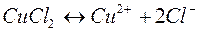
| Катодный процесс (-) | Анодный процесс (+) | |
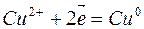
| 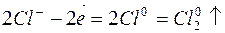
|
Продукты, образующиеся при электролизе на электродах в результате электрохимических реакций, называются первичными продуктами электролиза.
2. Электролиз раствора сульфата цинка 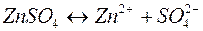
| Катодный процесс (-) | Анодный процесс (+) | |
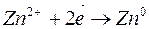
| 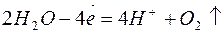
| |
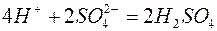
|
Продукты, образующиеся в растворе у электродов в результате вторичных реакций соединения, называются вторичными продуктами электролиза. В данном примере это образовавшаяся у анода серная кислота. Цинк и кислород, образовавшиеся на электродах, - первичные продукты электролиза.
3. Электролиз раствора хлорида натрия 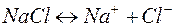
| Катодный процесс (-) | Анодный процесс (+) | |
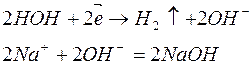
| 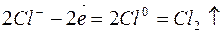
|
В приведённом примере первичными продуктами электролиза являются газы – водород и хлор, вторичными - гидроксид натрия, образовавшийся у катода.
4. Электролиз раствора сульфата натрия 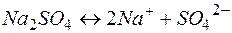
| Катодный процесс (-) | Анодный процесс (+) | |
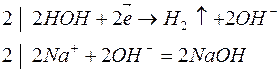
| 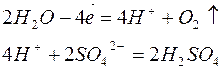
|
В данном случае, как и при электролизе кислородсодержащих кислот и щелочей, образуется 2 первичных (водород и кислород) и 2 вторичных (щелочь и кислота) продукта.
5. Электролиз расплава хлорида натрия 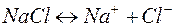
| Катодный процесс (-) | Анодный процесс (+) | |
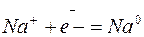
| 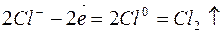
|
Примеры электролиза растворов электролитов
с растворимыми анодами.
6. Рафинирование (очистка от примесей) анода, изготовленного из меди с примесями Zn, Sn, Ag.
Электролитом в этом случае служит раствор соли меди, анодом – медь, загрязненная примесями, катодом – графит или пластинка из чистой меди. Прилагаемое из внешнего источника напряжение не превышает стандартный электродный потенциал меди ( 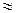 0,4 В):
0,4 В):
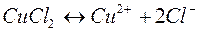
| Катодный процесс (-) | Анодный процесс (+) | |
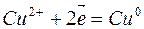
| 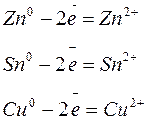
|
Для растворения серебра величина используемого напряжения недостаточна, и поэтому оно в нейтральном состоянии остается на дне электролизера в виде рыхлого осадка (в шламе). Для осаждения примесей на медном катоде требуется большое перенапряжение, и поэтому они остаются в растворе.
Подобно рафинированию методом электролиза производится покрытие одного металла другим (гальваностегия), и наносятся металлические покрытия на неметаллические полупроводниковые подложки (гальванопластика).
Приведенные примеры находят широкое применение в промышленности.
Законы Фарадея. Выход продукта по току
Количество веществ, образующихся при электролизе на электродах, можно рассчитать, пользуясь двумя законами электролиза, установленными Фарадеем в 1833 г. которые с учетом современной терминологии можно сформулировать в следующем виде:
1) количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества;
2) массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов.
Для расчетов используют математическое выражение обобщенного закона Фарадея:
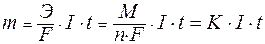 ,
,
| где: | Э – эквивалентная масса вещества (молярная масса эквивалента); F– постоянная Фарадея, равная 96500 Кл/моль;. I – сила тока, А; t – время проведения электролиза, с; М – молярная масса вещества; n – число отданных или принятых электронов; К – электрохимический эквивалент вещества. |
Практический расход тока при электролизе вследствие протекания побочных процессов (взаимодействие полученных веществ с электродом или электролитом) превышает его количество, рассчитанное согласно закону Фарадея. Следовательно, практическая масса полученных веществ отличается от теоретически рассчитанной. Отношение массы практически полученного вещества к теоретически рассчитанной массе, выраженное в процентах, называется выходом вещества по току:
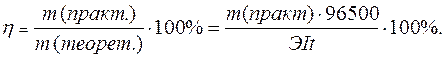
Примеры решения типовых задач.
Пример 1.Ряд активности металлов, электродных потенциалов.
Задача 1. Медная пластинка массой 10 г была погружена в раствор нитрата серебра, затем промыта водой и высушена. Масса ее оказалась равной 11,0 г. Сколько серебра из раствора выделилось на пластинке?
Решение. Для решения этой задачи необходимо знать стандартные электродные потенциалы металлов, т.е. место их в ряду напряжений (ряду активности металлов Бекетова).
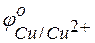 = +0.34 В;
= +0.34 В; 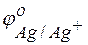 = +0.80 В.
= +0.80 В.
Из этих положительных потенциалов стандартный электродный потенциал меди менее положителен, следовательно, пойдёт реакция вытеснения:
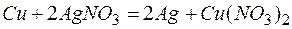
Для того чтобы вычислить количество серебра, выделившегося на медной пластинке, надо помнить, что медная пластинка в этой реакции и сама растворяется, теряя в массе.
Обозначим количество растворившейся меди через x г, тогда масса медной пластинки с учётом её растворения будет (10-х) г, масса выделившегося серебра на основе реакции:
64,0 г Cu – 2 ∙ 108 г Ag
х г Cu – (1+х) г Ag
216х =64+64х, 152x=64, x=0,42 г.
Таким образом, в течение реакции растворилось 0,42 г меди и выделилось 1,0 + 0,42 = 1,42 г серебра.
Пример 2. Работа гальванического элемента и расчёт ЭДС.
Задача 1. Напишите уравнения реакций, происходящих при работе гальванического элемента, состоящего из цинковой и серебряной пластин, опущенных в растворы своих солей с концентрацией катионов, равной 1 моль/л.
Решение. Стандартные электродные потенциалы цинкового и серебряного электродов соответственно равны:
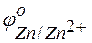 = –0,76 В;
= –0,76 В; 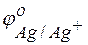 = +0,80 В.
= +0,80 В.
Металл, имеющий более отрицательное значение электродного потенциала при работе гальваничеcкого элемента, является анодом. В данном случае протекают реакции:
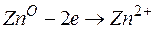
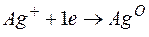
т.е. цинк, являясь анодом, растворяется при работе гальваничеcкого элемента, а серебро осаждается в виде металла на катоде. ЭДС гальванического элемента равна
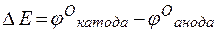 =
= 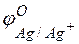 –
– 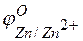 = +0,8 – (–0,76) =1,56 В.
= +0,8 – (–0,76) =1,56 В.
Пример 3. Зависимость электродных процессов от концентрации.
Задача 1. Рассчитайте, чему равна ЭДС элемента, составленного из медной и магниевой пластин, опущенных в растворы своих солей, если концентрация катиона у анода равна 0,1 моль/л, а у катода – 0,001 моль/л.
Решение. Стандартные электродные потенциалы магниевого и медного электродов соответственно равны:
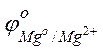 = –2,38 В;
= –2,38 В; 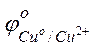 = +0.34 В.
= +0.34 В.
Следовательно, анодом будет магниевый электрод, катодом – медный. Электродный потенциал металла, опущенного в раствор с любой концентрацией катиона в растворе, определяют по формуле Нернста:
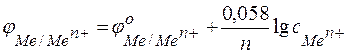 ,
,
где: с – концентрация катиона, моль/л;
п – число электронов, принимающих участие в реакции.
Отсюда потенциал магниевого электрода
 = –2,38 +
= –2,38 + 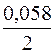 lg10–1 = –2,38 + 0,029(–1) = –2,409 В.
lg10–1 = –2,38 + 0,029(–1) = –2,409 В.
Потенциал медного электрода
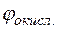 = +0,34 +
= +0,34 + 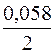 lg10–3 = +0,34 + 0,029(–3) = +0,253 В.
lg10–3 = +0,34 + 0,029(–3) = +0,253 В.
Тогда для гальванического элемента
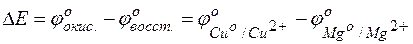 = +0,253–(–,409)=2,662В.
= +0,253–(–,409)=2,662В.
Пример 4. Определение возможности протекания реакции в гальвани-ческом элементе.
Задача 1. Исходя из величины стандартных электродных потенциалов и значения энергии Гиббса ΔGо298, укажите, можно ли в гальваническом элементе осуществить следующую реакцию:
Fe0 + Cd2+= Fe2+ + Cd0.
Решение. Надо составить схему гальванического элемента, отвечающего данной реакции. В этой реакции происходит восстановление ионов кадмия и окисление атомов железа:
Fe 0 – 2е = Fe 2+
Cd 2+ + 2е = Cd 0.
Пользуясь таблицей стандартных электродных потенциалов, определяем ЭДС этого гальваничекого элемента:
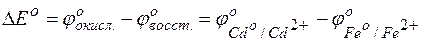 = –0,40– (–0,44)=0,04 В.
= –0,40– (–0,44)=0,04 В.
Изменение величины энергии Гиббса с величиной ЭДС связано соотношением:
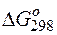 = – nF
= – nF 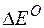 ,
,
где: 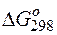 – изменение величины энергии Гиббса;
– изменение величины энергии Гиббса;
n – число электронов, принимающих участие в реакции;
F–число Фарадея;
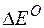 – ЭДС гальванического элемента.
– ЭДС гальванического элемента.
Находим 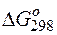 = –2∙96500∙0,04= – 7720 Дж.
= –2∙96500∙0,04= – 7720 Дж.
Так как 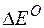 >0,
>0, 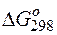 <0, следовательно, данную реакцию можно осуществить в гальваническом элементе. Реакция в прямом направлении идёт самопроизвольно.
<0, следовательно, данную реакцию можно осуществить в гальваническом элементе. Реакция в прямом направлении идёт самопроизвольно.
Пример 5. Расчет количества вещества, выделившегося при электролизе.
Задача 1. Какая масса меди осаждается на катоде при прохождении тока силой 2 А через раствор медного купороса в течение 15 минут?
Решение. Сначала нужно узнать количество электричества, прошедшее через раствор, выразив его в кулонах (1Кл=А.с). Количество электричества Q=I 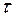 =2.15.60=1800 Кл. Молярная масса эквивалента меди (II) равна 64,0/2=32 г/моль. Следовательно:
=2.15.60=1800 Кл. Молярная масса эквивалента меди (II) равна 64,0/2=32 г/моль. Следовательно:
| 96500 Кл – 32 г |
| 1800 Кл – х г |
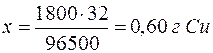
|
Пример 6. Определение электрохимического эквивалента и выхода по току.
Задача 1. При электролизе водного раствора AgNO3 в течение 50 минут при силе тока 3А выделилось 9,6 г серебра. Электролиз проводился с растворимым анодом. Напишите уравнение реакций катодного и анодного процессов и определите электрохимический эквивалент серебра в г/Кл и г/А.ч и выход по току.
Решение. Нитрат серебра диссоциирует:
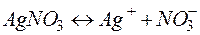
Процессы, протекающие на электродах:
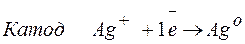
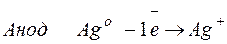
Молярная масса эквивалента AgО =108 г/моль.
Определяем массу серебра, которая выделилась бы теоретически при прохождении через раствор данного количества электричества:
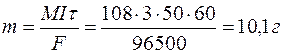
Выход по току
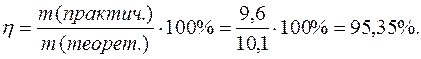
Электрохимический эквивалент
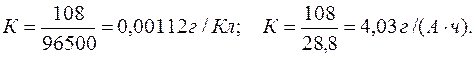
| <== предыдущая страница | | | следующая страница ==> |
| При составлении уравнений окислительно-восстановительных реакций в основном используют 2 метода: метод электронного баланса и метод электронно-ионного баланса | | | ОТ КОРРОЗИИ |
Дата добавления: 2014-10-14; просмотров: 903; Нарушение авторских прав

Мы поможем в написании ваших работ!