
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Диссоциация воды. Водородный показатель
Ионные реакции в растворах электролитов
Ионными реакциями (реакциями обмена) называют реакции в растворах электролитов, не сопровождающиеся изменением степеней окисления атомов элементов, входящих в состав реагирующих веществ.
Для выявления сущности процессов, происходящих при ионных реакциях, кроме молекулярных, составляют ионные уравнения реакций.
· При составлении ионных уравнений в виде ионов записывают только растворимые сильные электролиты. Все остальные вещества (неэлектролиты, слабые или малорастворимые электролиты) записывают в молекулярной форме.
Примеры реакций обмена:
· с образованием малорастворимых соединений:
Pb(NO3)2 + 2KI = PbI2¯ + 2KNO3
Pb2+ + 2NO3— + 2K+ + 2I— = PbI2¯ + 2K+ + 2NO3—
Pb2+ + 2I— = PbI2¯
· с образованием слабых электролитов:
NaNO2 + HCl = NaCl + HNO2
Na+ + NO2— + H+ + Cl— = Na+ + Cl— + HNO2
H+ + NO2- = HNO2
H2SO4 + 2NaOH = Na2SO4 + 2H2O
2H+ + SO42— + 2Na+ + 2OH— = 2Na+ + SO42— + 2H2O
H+ + OH— = H2O
HCl + NH4OH = NH4Cl + H2O
H+ + Cl— + NH4OH = NH4+ + Cl— + H2O
H+ + NH4OH = NH4+ + H2O
· с образованием газообразных веществ:
Na2CO3 + 2HCl = 2NaCl + СO2 + H2O
2Na+ + CO32— + 2H+ + Cl— = 2Na+ + Cl— + CO2 + H2O
CO32— + 2H+ = CO2 + H2O
Вода является слабым электролитом. Уравнение диссоциации воды упрощенно записывают следующим образом: H2O Û H+ + OH-. Константа диссоциации воды:
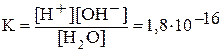 .
.
· Произведение 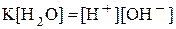 называют ионным произведением воды и обозначают
называют ионным произведением воды и обозначают 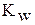 :
:
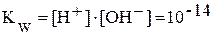 .
.
Ионное произведение воды при постоянной температуре постоянно не только для воды, но и для водных растворов. Зная концентрацию ионов H+, можно рассчитать концентрацию OH-, и наоборот. Понятия кислая, нейтральная и щелочная среда можно оценить количественно по концентрации ионов H+ или OH-. Более удобно для характеристики среды пользоваться водородным показателем:
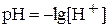 .
.
| Среда | рН | [H+], моль/л | [OH—], моль/л |
| Нейтральная | = 7 | 10 —7 | 10—7 |
| Кислая | < 7 | >10—7 | <10—7 |
| Щелочная | > 7 | <10—7 | >10—7 |
| <== предыдущая страница | | | следующая страница ==> |
| Растворы электролитов. Электролитическая диссоциация | | | Гидролиз солей |
Дата добавления: 2014-02-27; просмотров: 519; Нарушение авторских прав

Мы поможем в написании ваших работ!