
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Гидролиз солей
· Гидролизом солей называют процесс взаимодействия ионов соли с водой, приводящий к смещению ионного равновесия воды и, как правило, изменению рН среды.
Гидролиз солей происходит в тех случаях, когда ионы, образующиеся в результате диссоциации соли, способны образовать с ионами воды малодиссоциирующие частицы. Гидролиз чаще всего является обратимым процессом, так как продукты реакции взаимодействуют между собой с образованием исходных веществ.
Соли, образованные сильной кислотой и сильным основанием, например NaCl, KNO3, CaCl2 и др., гидролизу не подвергаются, их растворы нейтральны.
· Гидролизу подвергаются соли, образованные:
· слабыми кислотами и сильными основаниями (Na3PO4, K2SO3, Na2S и др.);
· слабыми основаниями и сильными кислотами (NH4Cl, AlCl3, ZnSO4 и др.);
· слабыми кислотами и слабыми основаниями (NH4CH3COO, NH4CN и др.).
· Гидролиз солей слабых кислот и сильных оснований.
Гидролиз NaNO2.
Диссоциация соли: NaNO2 = Na+ + NO2—
краткое ионное уравнение:
NO2— + HOH Û HNO2 + OH—(среда щелочная, рН>7);
молекулярное уравнение:
NaNO2 + H2O Û HNO2 + NaOH.
Гидролиз K2CO3 (гидролиз солей многоосновных кислот преимущественно происходит по первой ступени).
Диссоциация соли: K2CO3 = 2K+ + CO32 —
краткое ионное уравнение:
CO32 — + HOH Û HCO3- + OH—(среда щелочная, рН>7);
молекулярное уравнение:
K2CO3 + H2O Û KHCO3 + KOH.
По второй ступени гидролиз практически не идет.
· Гидролиз солей слабых оснований и сильных кислот.
Гидролиз NH4Cl.
Диссоциация соли: NH4Cl = NH4+ + Cl-
краткое ионное уравнение:
NH4+ + HOH Û NH4OH + H+ (среда кислая, рН<7);
молекулярное уравнение:
NH4Cl + H2O Û NH4OH + HСl.
Гидролиз AlCl3 (гидролиз солей многокислотных оснований преимущественно происходит по первой ступени):
AlCl3 = Al3+ + 3Cl—
Al3+ + HOH Û AlOH2+ + H+(среда кислая, рН<7);
молекулярное уравнение: AlCl3 + H2O Û AlOHCl2 + HСl.
По следующим ступеням гидролиз практически не идет.
· Гидролиз солей слабых оснований и слабых кислот.
В этом случае, если соль растворима, в реакции одновременно участвуют и катион, и анион соли, связывающие ионы OH— и H+ из воды, равновесие сильно смещается вправо, гидролиз усиливается. Значение рН раствора зависит от относительной силы кислоты и основания, образующих соль.
Гидролиз CH3COONH4:
CH3COONH4 = NH4+ + CH3COO—
NH4+ + CH3COO — + HOH Û NH4OH + CH3COOH
CH3COONH4 + H2O Û NH4OH + CH3COOH
Константы диссоциации уксусной кислоты и гидроксида аммония равны: 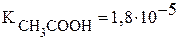 и
и 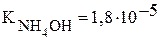 , поэтому реакция раствора данной соли нейтральная.
, поэтому реакция раствора данной соли нейтральная.
Растворимые соли, образованные многоосновными слабыми кислотами и многокислотными слабыми основаниями гидролизованы в растворе практически полностью с образованием кислоты и основания:
Сr2S3 + 6H2O = 2Cr(OH)3 + 3H2S.
Такие соли в водных растворах существовать не могут. В таблице растворимости им соответствует прочерк.
· Совместный гидролиз солей.
Если в растворе одновременно присутствуют две соли, одна из которых содержит катион слабого основания (Al3+, Fe3+, Cr3+, NH4+), а другая - анион слабой кислоты (СO32—, SO32—, S2—, SiO32—), то гидролиз необратим, идёт с образованием кислоты и основания. Пример реакции совместного гидролиза солей:
2AlCl3 + 3Na2CO3 + 6H2O = 2Al(OH)3 + 3H2CO3 + 6NaCl
2Al3+ + 3CO32— + 3H2O = 2Al(OH)3 + 3H2CO3.
Дата добавления: 2014-02-27; просмотров: 1352; Нарушение авторских прав

Мы поможем в написании ваших работ!