
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
|
Читайте также: |
10.1.Электролитическая диссоциация – это процесс распада электролита на ионы под действием полярных молекул растворителя.
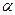 Количественные характеристики электролитов: степень диссоциации (
Количественные характеристики электролитов: степень диссоциации ( 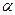 ) и константа диссоциации (Кд).
) и константа диссоциации (Кд). 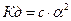
Сильные электролиты в водном растворе диссоциированы практически нацело (HNO3, HClO4, HCl, H2SO4, HBr, HJ, KOH, NaOH, Ca(OH)2, Ba(OH)2).
Слабые электролиты в водных растворах диссоциируют частично, то есть существуют как в виде гидратированных ионов, так и в виде недиссоциированных молекул: (H2CO3, H2S, HCN, H3SIO3, NH4, H2O и все малорастворимые в воде основания.)
Пример диссоциации:
| <== предыдущая страница | | | следующая страница ==> |
| РАСТВОРЫ | | | Сильных электролитов Слабых электролитов |
Дата добавления: 2014-09-08; просмотров: 263; Нарушение авторских прав

Мы поможем в написании ваших работ!