
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
РАСТВОРЫ
9.1.Раствор твердая или жидкая гомогенная система, состоящая из двух или более компонентов (составных частей), относительные количества которых могут изменяться в широких пределах. Наиболее важные жидкие растворы.
Раствор состоит из растворителя и растворенного вещества. Растворитель-компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор. Если оба компонента до растворения находились в одинаковом агрегатном состоянии (спирт и вода), то растворителем считается компонент, находящимся в большем количестве.
Системы с размером частиц менее 1 нм образуют истинные растворы. Они состоят из молекул, атомов или ионов растворëнного вещества, их следует рассматривать как однофазные системы. Такие системы называются гомогенными, внутри них отсутствуют поверхности раздела - все части однородны по составу и свойствам.
В сельскохозяйственной практике пользуются растворами для борьбы с вредителями и болезнями растений и животных, для протравливания семян, для борьбы с сорняками и т.д. Поэтому специалисты сельского хозяйства, должны быть хорошо знакомы со свойствами растворов и уметь приготавливать растворы разного назначения.
В химической практике используются различные способы количественного выражения состава раствора.
Сходства растворов с химическими веществами:
1)однородность
2)выделение теплоты при растворении
Отличия растворов от химических веществ:
1)состав раствора может изменяться в разных пределах.
2)в свойствах раствора можно обнаружить многие свойства его отдельных компонентов.
Растворы занимают промежуточное положение между химическими соединениями и механическими смесями.
Насыщенный раствор - раствор, находящийся в равновесии с растворяющемся веществом.
Ненасыщенный раствор-раствор с меньшей концентрацией растворенного вещества, чем в насыщенном растворе.
Концентрация раствора - это кол-во растворенного вещества, содержащегося определенном количестве раствора или растворителя.
Концентрированные растворы - растворы с относительно высоким содержанием растворенного вещества.
Разбавленные растворы - растворы с относительно низким содержанием растворенного вещества.
9.2.Способы выражения концентрации растворов.
Количественный состав раствора определяется его концентрацией, т.е. относительным содержанием компонентов, составляющих раствор.
Концентрацией называется содержание растворенного вещества в единице массы или объема раствора.
Существует много способов выражения концентраций. Наиболее применяемы следующие:
1) Массовая доля выражается числом, показывающим какую долю составляет масса растворенного вещества (mв) от массы раствора (mр). Эта безразмерная величина выражается в долях единицы или в процентах. Если обозначить массовую долю 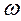 (%), то можно записать:
(%), то можно записать:
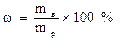
Если масса раствора находится по его объему V (мл) и плотность р (г/мл), то есть mв=V*p
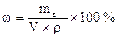
2) Молярная концентрация (молярность) См показывает количество растворенного (число молей) вещества, содержащегося в 1 л раствора (моль/л):
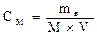
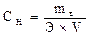
3) Молярная концентрация эквивалентов (нормальность) Сн показывает число моль эквивалентов растворенного вещества (число эквивалентов Нэкв), содержащегося в 1 л раствора (моль/л) или (моль экв./л)
Произведение эквивалентной концентрации раствора на его объем в литрах показывает общее число эквивалентов, содержащихся в данном объеме раствора. Обозначив эквивалентные концентрации двух реагирующих растворов через Сн1 и Сн2, а их объемы через V1 и V2, получим:
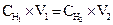
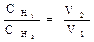
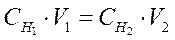 Объемы реагирующих друг с другом растворов обратно пропорциональны их эквивалентным концентрациям.
Объемы реагирующих друг с другом растворов обратно пропорциональны их эквивалентным концентрациям.
4) Титр (Т) – масса растворенного вещества (г) в 1 мл раствора.
Т=m/V, T=N*Э/1000, отсюда N=T*1000/Э, где
N – молярная концентрация эквивалента.
Э – эквивалент.
5) Моляльность раствора (с m) - концентрация раствора, выраженная числом молей растворённого вещества, содержащегося в 1000 г растворителя
Вычисляется как отношениес m=υ/m2,
где:
ν — количество растворённого вещества, моль;
m2 — масса растворителя, кг.
Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным.
Следует обратить особое внимание, что, несмотря на сходство названий, молярная концентрация и моляльность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры.
9.3. Пример приготовления растворов необходимой концентрации различными способами.
Пример 1. Определите массовую долю (в %) хлорида натрия в растворе, содержащем 80 г соли в 500 г раствора.
Решение: Массовая доля выражается соотношением:
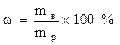
Следовательно 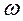 = (80/500)*100= 16 %.
= (80/500)*100= 16 %.
Пример 2. Сколько граммов воды надо прибавить к 800 г 60 % раствора H2SO4 для получения 40 % раствора?
Решение: Обозначим массу воды, которую требуется прибавить, через Х. Тогда исходя из формулы
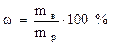
запишем: [800*0,6/(800 + Х)]*100, откуда Х = 400 г Н2О.
Пример 3. 500 мл раствора H2SO4 содержит 196 г H2SO4. Определите молярную и эквивалентную концентрацию раствора H2SO4.
Решение: 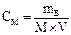
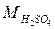 = 98 г/моль,
= 98 г/моль,
М – молярная масса,
См= 196/(98*0.5)= 4 моль/л, где 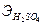 = 49 г/моль,
= 49 г/моль,
Сн= 196/(49*0.5)= 8н, то есть 8 эквивалентов в 1 л раствора.
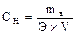
Пример 4. Определите эквивалентную и молярную концентрации 10% раствора Na2CO3, плотность которого 1,102 кг/м3.
Решение: Молярная и эквивалентная массы составляют: 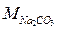 =106 г/моль,
=106 г/моль, 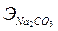 =54 г/моль. Поскольку молярная и эквивалентная концентрации относятся к 1 л раствора, определим массу 1 л раствора:
=54 г/моль. Поскольку молярная и эквивалентная концентрации относятся к 1 л раствора, определим массу 1 л раствора:
mв=V*p=1102*10-3=1,102 кг в этом растворе содержится 1,102*0,1=0,1102 кг Na2CO3, или 110,2г что составляет: См=110,2/106=104 моль/л, Сн=110,2/53=2,08н
Пример5. Для нейтрализации 50 мл раствора серной кислоты израсходовано 25 мл 0,4 н раствора щелочи. Определите эквивалентную концентрацию раствора серной кислоты.
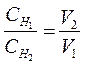 Решение: Из закона эквивалентов следует:
Решение: Из закона эквивалентов следует:
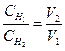
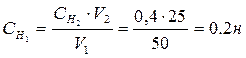 Отсюда
Отсюда 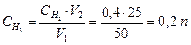 0,2 эквивалента в 1 л раствора.
0,2 эквивалента в 1 л раствора.
9.4. Задания для контрольной работы.
161. Вычислите молярную и моляльную концентрацию эквивалента 20%-ного раствора хлорида кальция плотностью 1,178 г/см3. Ответ: 2,1 М; 4,2 н.
162. Чему равна нормальность 30%-ного раствора NaOH плотностью 1,328 г/см3? К 1 л этого раствора прибавили 5 л воды. Вычислите массовую долю полученного раствора. Ответ: 9,96 н; 6,3%.
163. К 3 л 10-ного раствора HNO3 плотностью 1,054 г/см3 прибавили 5 л 2%-ного раствора той же кислоты плотностью 1,009 г/см3. Вычислите массовую долю в процентах и молярную концентрацию полученного раствора, объем которого равен 8 л. Ответ: 5,0%; 0,82 М.
164. Вычислите эквивалентную и моляльную концентрацию 20,8%-ного раствора HNO3 плотностью 1,12 г/см3. Сколько граммов кислоты содержится в 4 л этого раствора? Ответ: 3,70 н; 4,17 м; 931,8 г.
165. Вычислите молярную, эквивалентную и моляльную концентрации 16%-ного раствора хлорида алюминия плотностью 1,149 г/см3. Ответ: 1,38 М; 4,14 н; 1,43 м.
166. Сколько и какого вещества останется в избытке, если к 75 см3 0,3 н раствора H2SO4 прибавить 125 см3 0,2 н раствора KOH? Ответ: 0,14 г KOH.
167. Для осаждения в виде AgCl всего серебра, содержащегося в 100 см3 раствора AgNO3, потребовалось 50 см3 0,2 н раствора HCl. Какова нормальность раствора AgNO3? Какая масса AgCl выпала в осадок? Ответ: 0,1 н; 1,433 г.
168. Какой объем 20,01%-ного раствора HCl (пл. 1,100 г/см3) требуется для приготовления 1 л 10,17%-ного раствора (пл. 1,050 г/см3)? Ответ: 485,38 см3.
169. Смешали 10 см3 10%-ного раствора HNO3 (пл. 1,056 г/см3) и 100 см3 30%-ного раствора HNO3 (пл. 1,184 г/см3). Вычислите процентную концентрацию полученного раствора. Ответ: 28,38 %.
170. Какой объем 50%-ного раствора KOH (пл. 1,538 г/см3) требуется для приготовления 3 л 6%-ного раствора (пл. 1,048 г/см3)? Ответ: 245,5 см3.
171. Какой объем 10%-ного раствора карбоната натрия (пл. 1,105 г/см3) требуется для приготовления 5 л 2%-ного раствора (пл. 1,02 г/см3)? Ответ: 923,1 см3.
172. На нейтрализацию 31 см3 0,16 н раствора щелочи требуется 217 см3 раствора H2SO4. Чему равны нормальность и титр раствора H2SO4. Ответ: 0,023 н; 1,127*10-3 г/см3.
173. Какой объем 0,3 н раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3? Ответ: 25,6 см3.
174. На нейтрализацию 1 л раствора, содержащего 1,4 г KOH, требуется 50 см3 раствора кислоты. Вычислите нормальность раствора кислоты. Ответ: 0,53 н.
175. Какая масса HNO3 содержалась в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н раствора NaOH? Каков титр раствора NaOH? Ответ: 0,882 г; 0,016 г/см3.
176. Какую массу NaNO3 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор? Ответ: 100 г.
177. Смешали 300 г 20%-ного раствора и 500 г 40%-ного раствора NaCl. Чему равна процентная концентрация полученного раствора? Ответ: 32,5%.
178. Смешали 247 г 62%-ного и 145 г 18%-ного раствора серной кислоты. Какова процентная концентрация полученного раствора? Ответ: 45,72%.
179. Из 700 г 60%-ной серной кислоты, выпариванием удалили 200 г воды. Чему равна процентная концентрация оставшегося раствора? Ответ: 84%.
180. Из 10 кг 20%-ного раствора при охлаждении выделилось 400г соли. Чему равна процентная концентрация охлажденного раствора? Ответ: 16,7%.
| <== предыдущая страница | | | следующая страница ==> |
| КОЛЛОИДНЫЕ РАСТВОРЫ | | | ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ |
Дата добавления: 2014-09-08; просмотров: 734; Нарушение авторских прав

Мы поможем в написании ваших работ!