
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Сильных электролитов Слабых электролитов
H2SO4«H++HSO-4 H3S«H++HS-
HSO4«H++SO4 HS«H++S2-
H2SO4«2H++SO42-
Ca(OH)2«CaOH++OH- Fe(OH)2«FeOH++OH-
CaOH+«Ca2++OH- FeOH+«Fe2++OH-
Ca(OH)2« Ca2++2OH-
Соли диссоциируют в водном растворе с образованием катионов металла и анионов кислотного остатка.
Al2(SO4)3«2Al3++3SO42-
K2SO4«2K++SO32-
Выражение константы диссоциации можно записать для слабого электролита.
NH4OH«NH+4+OH- HCN«H++CN-
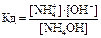
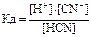
Связь константы диссоциации и степени диссоциации.
Закон разбавления Оствальда 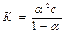 или приближенно, если
или приближенно, если 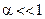
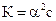
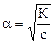
10.2.Ионное произведение воды. Водородный показатель.

На основании закона действия масс. Для воды и разбавленных растворов электролитов, произведение концентрации ионов водорода и гидроксид-ионов соли, величина постоянная.
Степень кислотности или щелочности раствора характеризуется концентрацией иона водорода [H+]:
СРЕДА [H+], моль/л
| Нейтральная | 10-7 |
| Кислая | >10-7 (10-6, 10-5, 10-3) |
| Щелочная | <10-7 (10-8, 10-9, 10-10) |
Кислотность или щелочность раствора можно характеризовать величиной водородного показателя рН.
Водородный показатель рН – это отрицательный десятичный логарифм концентрации ионов водорода
РН = – lg [H+]
Гидроксильный показатель рОН – это отрицательный десятичный логарифм концентрациигидроксид – ионов
PОН = – lg[OH–]
Среда pH
| Нейтральная | |
| Кислая | <7 (6,5,3) |
| Щелочная | >7 (8,9,10) |
рН+рОН=14
10.3.Формулы для расчета рH сильных и слабых электролитов.
1) кислота – сильный электролит
рH=-lg[H+] ; [H+]=Cкислоты.
2) кислота – слабый электролит.
рH=-lg[H+] ;[H+]= 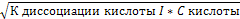
3)основание – сильный электролит
рOH=-lg[OH-] ;[OH-]=Cоснования
рH=14-pOH
4) основание - слабый электролит
рOH=-lg[OH-];
[OH-]= 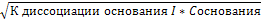
рH=14-pOH
Значение кислотности среды.
 |
| <== предыдущая страница | | | следующая страница ==> |
| ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ | | | Реакция рН |
Дата добавления: 2014-09-08; просмотров: 510; Нарушение авторских прав

Мы поможем в написании ваших работ!