
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Реакция рН
раствора 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
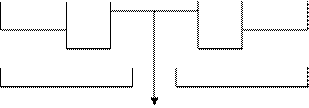 |
сильно слабо слабо сильно
средне средне
КИСЛАЯ ЩЕЛОЧНАЯ
НЕЙТРАЛЬНАЯ
СРЕДА.
10.4.Значение водородного показателя
| Почва | рН | Расте-ние | опт. рН | Раствор | рН | Сок | рН |
| Черно-зем | Карто-фель | 4 – 8 | Кровь | 7,4 | Карто-фель розо-вый | 5,92 | |
| Подзо-листая | 3,5 – 6 | Клевер | 5 – 8 | Желу-дочный сок | 1,7 | Мор-ковь | 6,67 |
| Солон-чаки | 8 – 9 | Свекла | 6 – 8 | Водопр. вода | 7,5 | Яблоки анто-новка | 2,50 |
10.5. Примеры решения задач.
Пример 1. Вычислить рН, рОН, [Н+] , [ОН-] в 0.01М HCl.
Решение. Соляная кислота относится к сильным кислотам, поэтому можно принять концентрацию ионов водорода равной концентрации кислоты [Н+] =0.01моль/л. Значение рН вычисляется по формуле ( 1) и равно рН= -lg 0.01 =2. Концентрацию гидроксид-ионов можно найти, зная величину ионного произведения воды:
[ОН-] =10-14/[Н+] = 10-14/0.01 = 10-12
Значение рOH = -lg 10-12 =12
Кроме того величину рОН можно найти из известного равенства
рН + рОН = 14
10.6.Задания для контрольной работы
1.Запишите уравнения процесса диссоциации, выражение константы диссоциации, степени диссоциации (для слабых электролитов) и рассчитайте рН для указанной концентрации.
| № варианта | Задание 1 |
| Серная кислота (1М) | |
| Гидроксид аммония (0,025н.) | |
| Азотистая кислота (0,25М) | |
| Азотная кислота (0,65н.) | |
| Гидроксид натрия (0,17М.) | |
| Сероводородная кислота (0,36н.) | |
| Гидроксид калия (0,3М) | |
| Хлорная кислота (0,6н.) | |
| Хлороводородная кислота (2н.) | |
| Гидроксид аммония (0,1М) | |
| Угольная кислота (0,05н.) | |
| Метакремниевая кислота (0,2М) | |
| Бромоводородная кислота (0,5н.) | |
| Гидроксид калия (1М) | |
| Сероводородная кислота (0,3н.) | |
| Гидрокисд аммония (0,02М) | |
| Азотистая кислота (2н.) | |
| Хлорная кислота (1М) | |
| Гидроксид лития (0,05н.) | |
| Циановодородная кислота (0,08М) |
| <== предыдущая страница | | | следующая страница ==> |
| Сильных электролитов Слабых электролитов | | | ИОННО-МОЛЕКУЛЯРНЫЕ УРАВНЕНИЯ РЕАКЦИЙ ОБМЕНА |
Дата добавления: 2014-09-08; просмотров: 317; Нарушение авторских прав

Мы поможем в написании ваших работ!