
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ПРИМЕНЕНИЕ ТЕОРИИ СТОЛКНОВЕНИЙ К БИМОЛЕКУЛЯРНЫМ РЕАКЦИЯМ. РАСЧЕТ КОНСТАНТЫ СКОРОСТИ
Исходя из молекулярно-кинетической теории и гипотезы активных столкновений, теоретическая интерпретация бимолекулярной реакции типа
A + В ®Продукты,
может быть следующей. Элементарный акт происходит только при столкновении реагирующих частиц. Если суммарная энергия сталкивающихся молекул меньше некоторой критической величины ea, вероятность реакции равна нулю. Если суммарная энергия сталкивающихся молекул равна ea или как угодно больше этой критической величины, вероятность реакции равна некоторой конечной величине Р. Тогда согласно сделанному утверждению скорость реакции можно записать так:
-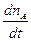 = PZa = PnAnBs2AB{8pkT(
= PZa = PnAnBs2AB{8pkT( +
+ 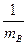 )}1/2e-
)}1/2e- .
.
Это соотношение и является основным математическим выражением теории столкновений для бимолекулярных реакций. Из него могут быть получены различные практически применимые формы и связь между константой скорости и молекулярными параметрами реагирующей системы. Если концентрации реагирующих молекул выразить в моль/см-3.
cA = 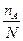 cB =
cB =  ,
,
то уравнение будет иметь вид
-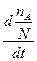 = -
= -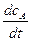 = P
= P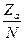 = PcAcBNs2AB{8pkT(
= PcAcBNs2AB{8pkT( +
+ 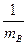 )}e-
)}e- .
.
Между тем для рассматриваемой бимолекулярной реакции из основного постулата химической кинетики имеем
-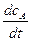 = kcAcB.
= kcAcB.
Сравнение уравнений дает теоретическое выражение для константы скорости бимолекулярной реакции:
k = P Ns2AB{8pkT( +
+ 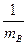 )}e-
)}e- .
.
При выражении молекулярных параметров в мольных величинах уравнение принимает вид
k = P Ns2AB{8pRT(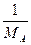 +
+ 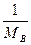 )}1/2e-
)}1/2e-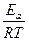 ,
,
или, объединив постоянные величины в предэкспоненциальный множитель
Ns2AB{8pR(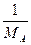 +
+ 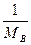 )}1/2 = const,
)}1/2 = const,
называемый фактором столкновений
k = P const 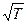 e-
e-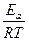 .
.
После логарифмирования получим
lnk = ln(P const) +  lnT -
lnT - 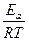 ,
,
и после дифференцирования уравнения будем иметь
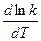 =
=  .
.
Сравнив уравнение с уравнением Аррениуса, получим
E = Ea + 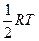 .
.
Поскольку большинство химических реакций проводится при температурах до 1000 °К, а энергии активации имеют порядок 104— 105 кал/моль, величиной
RT » T£ 1000 кал/моль можно пренебречь и уравнение записать так:
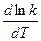 =
= 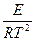 ;
;
или
k = const e-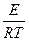 ,
,
что совпадает с уравнением Аррениуса. Из сказанного ясно, что использование уравнения оправдано, когда энергии активации достаточно высоки (E >> RT).Если это условие не соблюдается, следует использовать более точное уравнение.
| <== предыдущая страница | | | следующая страница ==> |
| ТЕОРИЯ АКТИВНЫХ СТОЛКНОВЕНИЙ МОЛЕКУЛ | | | БИМОЛЕКУЛЯРНЫЙ МЕХАНИЗМ АКТИВАЦИИ МОНОМОЛЕКУЛЯРНОЙ РЕАКЦИИ |
Дата добавления: 2014-03-11; просмотров: 547; Нарушение авторских прав

Мы поможем в написании ваших работ!