
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
НЕОБРАТИМАЯ РЕАКЦИЯ ВТОРОГО ПОРЯДКА
Примером реакции второго порядка в растворе может служить омыление эфира щелочью:
СН3СООС2Н5 + NaOH ® CH3COONa + C2H5ОH .
В общем виде необратимая реакция второго порядка описывается стехиометрическим уравнением
А + В ®C + D .
Пусть в момент времени t = 0 имеется а мольвещества А и bмольвещества В. Пусть к моменту времени tпрореагирует х мольвещества А. Из уравнения реакции ясно, что при этом прореагирует и х мольвещества В,
т.е. к моменту времени tостанутся непрореагировавшими (а—x)мольвещества А и (b—х) мольвещества В. Если объем системы обозначить через V, то скорость реакции можно записать следующим образом:
-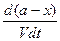 = k`
= k`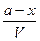
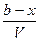 .
.
Сократив обе части уравнения на Vи продифференцировав, получим
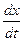 =
= 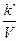 (a-x)(b-x).
(a-x)(b-x).
Если объем V системы постоянен, то его можно ввести в константу, т. е.
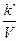 = k.
= k.
Тогда уравнение примет вид
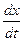 = k (а — x) (b — х).
= k (а — x) (b — х).
Уравнение и есть дифференциальное уравнение скорости необратимой реакции второго порядка. Интегрируя это уравнение c учетом начальных условий, получим
k = 
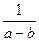 ln
ln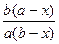 .
.
Если исходные количества веществ А и В будут равны, т.е. a = b , то дифференциальное уравнение скорости запишется так:
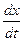 = k(a-x)2 .
= k(a-x)2 .
Разделив переменные и проинтегрировав в пределах от 0 до t и от 0 до х, получим k = 
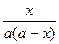 .
.
Когда количество прореагировавшего вещества будет равно половине исходного, т. е. когда х = а/2,значение tбудет равно t, т. е. времени полураспада. Подставив эти величины в уравнение , получим
t = 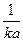 ,
,
т.е. время полураспада для реакции второго порядка обратно пропорционально количеству исходного вещества.
| <== предыдущая страница | | | следующая страница ==> |
| НЕОБРАТИМАЯ РЕАКЦИЯ ПЕРВОГО ПОРЯДКА | | | ОБРАТИМАЯ РЕАКЦИЯ ВТОРОГО ПОРЯДКА |
Дата добавления: 2014-03-11; просмотров: 441; Нарушение авторских прав

Мы поможем в написании ваших работ!