
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ОБРАТИМАЯ РЕАКЦИЯ ВТОРОГО ПОРЯДКА
А D В.
ОБРАТИМАЯ РЕАКЦИЯ ПЕРВОГО ПОРЯДКА
В общем случае стехиометрическое уравнение обратимой реакции первого порядка имеет вид
Реакция одновременно протекает в двух противоположных направлениях, поэтому скорость такой реакции равна разности скоростей прямой и обратной реакций, каждая из которых является реакцией первого порядка, т.е. -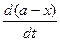 = k1(a - x) – k2(b + x),
= k1(a - x) – k2(b + x),
где aи b — соответственно исходное количество вещества А и В, моль;x — количество вещества А, прореагировавшее к моменту времени t, моль.
Это следует из принципа независимости(принципа сосуществования) прямой и обратной реакций. Согласно этому принципу, если в системе одновременно протекает несколько реакций, то каждая из них независима от остальных и скорость ее прямо пропорциональна концентрациям реагирующих веществ. Конечное изменение концентрации данного вещества является результатом всех независимых изменений.
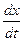 = k1(a - x) – k2(b + x).
= k1(a - x) – k2(b + x).
После преобразования уравнения будем иметь
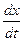 = (k1 + k2)(
= (k1 + k2)(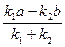 - x).
- x).
Пусть
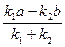 = L ,
= L ,
тогда выражение примет вид
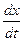 = (k1 + k2)(L – x).
= (k1 + k2)(L – x).
Разделив переменные, получим
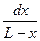 = (k1 + k2)dt.
= (k1 + k2)dt.
Проинтегрировав это выражение в пределах, соответственно от 0 до хи от 0 до t,и, решив его относительно k1 +k2, получим
k1 + k2 =  ln
ln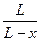 .
.
Следовательно, для нахождения суммы констант скоростей прямой и обратной реакций надо знать величину L, которую можно найти, разделив числитель и знаменатель в уравнении на k2и приняв во внимание, что
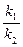 = K ,
= K ,
где K — константа равновесия . В результате получим
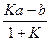 = L.
= L.
Следовательно, для нахождения величины L необходимо знать константу равновесия данной реакции. Скорости прямой и обратной реакций в момент равновесия одинаковы, поэтому
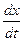 = 0.
= 0.
Oтметив количество вещества А, прореагировавшее к моменту равновесия, индексом ¥, получим
k1(a - x¥) – k2(b + x¥) = 0.
Отсюда
K = 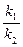 =
= 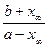 .
.
Зная числовое значение L, можно рассчитать сумму констант скоростей k1 + k2 ,кроме того, зная числовое значение константы равновесия и учитывая, что она равна отношению констант скоростей прямой и обратной реакций, можно рассчитать каждую константу скорости в отдельности.
Иногда обратимую реакцию первого порядка формально удобно рассматривать как необратимую. Для этого можно считать, что к концу реакции прореагирует x¥ исходного вещества. Тогда дифференциальное уравнение скорости реакции будет иметь вид
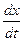 = k(x¥ - x).
= k(x¥ - x).
Разделив переменные и проинтегрировав соответственно в пределах от 0 до х и от 0 до t, получим
k =  ln
ln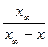 .
.
Как видно из уравнений,
L = x¥;
k = k1 + k2.
В общем виде эту реакцию можно записать так:
А + В D C + D.
Так же, как в предыдущем случае, скорость реакции будет равна разности скоростей прямой и обратной реакций, т. е.
-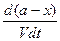 = k`1CACB – k`2CCCD,
= k`1CACB – k`2CCCD,
где а—исходное число молей вещества А; х—число молей вещества А, прореагировавших к моменту времени t; V—объем системы; k`1 и k`2 — константы скоростей прямой и обратной реакций; С—концентрация реагирующих веществ моменту времени t
После дифференцирования получаем
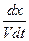 = k`1CACB – k`2CCCD.
= k`1CACB – k`2CCCD.
Рассмотрим наиболее простой случай, когда числа молей исходных веществ в начальный момент времени t = 0 одинаковы и равны величине а, а количества молей конечных веществ равны нулю. Тогда выражение примет вид
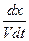 = k`1
= k`1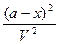 - k`2
- k`2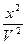 .
.
Сократив обе части уравнения на величину V,получим
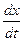 = k1(a – x)2 – k2x2 ,
= k1(a – x)2 – k2x2 ,
где k1 = ; k2 = .
В результате алгебраических преобразований будем иметь
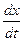 = (k1 – k2)(x2 - 2
= (k1 – k2)(x2 - 2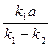 x +
x + 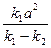 ).
).
Выражение в скобках можно представить как произведение двух двучленов. Тогда
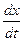 = (k1 – k2)(m1 – x)(m2 – x),
= (k1 – k2)(m1 – x)(m2 – x),
где m1и m2 — корни квадратного уравнения, которое можно записать так:
x2 - 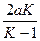 x +
x + 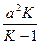 = 0,
= 0,
где K = k1/k2 — константа равновесия.
Корни уравнения равны
m1,2 = 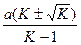 .
.
Разделив переменные в уравнении и проинтегрировав его, получим
k1 – k2 = 
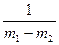 ln
ln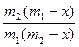 .
.
Зная константу равновесия K,можно найти константы скоростей прямой k1и обратной k2реакций.
| <== предыдущая страница | | | следующая страница ==> |
| НЕОБРАТИМАЯ РЕАКЦИЯ ВТОРОГО ПОРЯДКА | | | ПАРАЛЛЕЛЬНЫЕ РЕАКЦИИ |
Дата добавления: 2014-03-11; просмотров: 456; Нарушение авторских прав

Мы поможем в написании ваших работ!