
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
НЕОБРАТИМАЯ РЕАКЦИЯ ПЕРВОГО ПОРЯДКА
КИНЕТИЧЕСКАЯ КЛАССИФИКАЦИЯ РЕАКЦИЙ
Реакции разделяют по следующим признакам:
1. По числу молекул, участвующих в реакции (молекулярность и порядок реакции).
Молекулярность реакции определяется числом молекул, одновременным взаимодействием между которыми осуществляется акт химического взаимодействия.
По этому признаку реакции разделяются на одно-, дву-, и трехмолекулярные.
Порядок реакции равен сумме показателей степеней концентраций в уравнении, выражающем зависимость скорости реакции от концентраций реагирующих веществ.
Реакция первого порядка - - = k C.
Реакция второго порядка - - = k C1C2.
Реакциями нулевого порядка называют процессы, в которых скорость процесса сохраняется постоянной во времени – v = const.
Примером несовпадения молекулярности и порядка может служить способ проведения реакции на примере следующей реакции:
СН3СООС2Н5 + Н2О = СН3СООН + С2Н5ОН.
В зависимости от способа контактирования реагирующих веществ, в этой реакции при неизменной молекулярности, равной двум, порядок реакции может равняться двум, единице и нулю.
2. По природе частиц, участвующих в реакции.
Реакции, в которых участвуют молекулы, называются молекулярными.
Реакции с участием ионов называются ионными.
Реакции с участием атомов или свободных радикалов называются цепными.
3. По числу фаз, участвующих в реакции.
Реакции, протекающие в одной фазе, называются гомогенными. Реакции, протекающие на границе раздела фаз, называются гетерогенными.
4. По степени сложности реакции подразделяются на:
а) обратимые и необратимые.
Обратимые реакции, это реакции в которых продукты реакции могут взаимодействовать с образованием исходных веществ.
Необратимыми являются обычно такие реакции, в ходе которых хотя бы один из продуктов удаляется из сферы реакции;
б) изолированные и параллельные.
Изолированные реакции – реакции, дающие продукт только одного типа. Параллельные реакции – такие, в которых взятые вещества одновременно реагируют в двух или более направлениях
в) сопряженные реакции.
Это совместные реакции вида
A + B ®M;
A + C ® N, из которых одна протекает лишь совместно с другой;
г) последовательные реакции (многоступенчатые или консекутивные).
В этих реакциях наблюдаются промежуточные стадии А®В®С. Вещество В является промежуточным продуктом в процессе получения вещества С.
Если одна из составляющих реакций обладает много меньшей скоростью, чем остальные, то общая скорость реакции определяется этой наиболее замедленной стадией.
Кинетическое уравнение реакции первого порядка можно вывести следующим образом. Пусть в начальный момент времени имеется амоль исходного вещества А. Если к моменту времени tпрореагировало xмольвещества, то в смеси осталось (а — х) моль, Тогда концентрация вещества А в момент времени tравна
CA = 
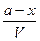 ,
,
где V — объем системы.
Согласно определению скорость реакции первого порядка прямо пропорциональна концентрации реагирующего вещества в первой степени. Следовательно, из основного кинетического уравнения получим
-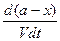 =
= 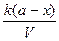 .
.
Сократив обе части уравнения на V, будем иметь
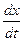 = k(a-x).
= k(a-x).
Это и есть дифференциальное уравнение скорости необратимой реакции первого порядка. Разделив переменные, получим
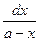 = kdt .
= kdt .
После интегрирования получим
- ln (а - х) = kt + С .
Постоянную интегрирования С можно найти, подставив начальные условия (t = 0; х = 0) в выражение
-lna = С ;
k = ln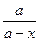 .
.
Выражение путем деления числителя и знаменателя дроби, стоящей под знаком логарифма, на объем (при условии, что он постоянен) можно переписать:
k = ln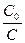 ,
,
где Со— исходная концентрация реагирующего вещества; C — концентрация этого вещества к моменту времени t.
Как видно из выражений, величина kимеет размерность обратного времени.
Следовательно, константу скорости реакции первого порядка можно выражать в с-1,мин-1 или ч-1.
Освободившись от логарифма, получим
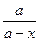 = еkt ;
= еkt ;
a-x = ae-kt ;
x = a(1 – e-kt).
По уравнениям можно определить количество (а—х)вещества А, непрореагировавшее к моменту времени t, количество хэтого вещества, прореагировавшее к моменту времени t,или, другими словами, количество вещества В, образовавшегося к моменту времени t.

На рисунке зависимости прореагировавшего хи оставшегося а—хколичества исходного вещества А от времени показаны графически. Из рисунка и из уравнений видно, что полное исчезновение исходного вещества произойдет через бесконечно большой промежуток времени. В практических расчетах за конец реакции принимается тот момент, когда аналитическим способом исходное вещество обнаружить невозможно. Время, соответствующее точке пересечения кривых, обозначено через t. Очевидно, что в точке пересечения
а – х = х;
х = ,
т. е. к моменту времени t прореагирует половина исходного вещества.
Поэтому время t называется временем полураспада.
ае-kt = a(1 – e-kt);
2e-kt = 1;
ekt = 2;
t = .
Таким образом, время полураспада не зависит от количества исходного вещества. Это понятно для простых мономолекулярных реакций, так как превращение молекул в этих реакциях является спонтанным (не зависящим от присутствия остальных).
| <== предыдущая страница | | | следующая страница ==> |
| СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ | | | НЕОБРАТИМАЯ РЕАКЦИЯ ВТОРОГО ПОРЯДКА |
Дата добавления: 2014-03-11; просмотров: 599; Нарушение авторских прав

Мы поможем в написании ваших работ!