
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
ВВЕДЕНИЕ
Химическая кинетика изучает скорость химических процессов и зависимость ее от различных факторов.
Прикладное значение кинетики заключается в том, что для управления химической реакцией необходимо знать скорость ее протекания в данных условиях и способы ее изменения.
Теоретическое значение кинетики заключается в выяснении механизма химических реакций.
В химической кинетике возникают дополнительные трудности в связи с появлением новой переменной – времени и влиянием большого числа других факторов, часто даже трудно учитываемых.
Кинетические исследования состоят в решении таких проблем, как определение порядка и константы скорости реакций, числа и характера промежуточных продуктов, энергии активации реакции и т.д.
Скоростью химической реакции называется число молекул или молей данного вещества, реагирующих в единицу времени в единице объема.
В общем виде химическую реакцию можно написать так:
n1А1 + n2А2 + ……+niАi ® n`1A`1 + n`A`2 + …..+n`iA`i,
где ni и n`i - стехиометрические коэффициенты исходных и полученных веществ; Аi и А`i - исходные и полученные вещества.
Для определения скорости химической реакции достаточно знать изменение концентрации количества одного из присутствующих в реакции веществ, так как изменение количества всех остальных веществ можно определить из уравнения химической реакции.
Реагируют только те молекулы, которые сталкиваются. Число столкновений прямо пропорционально числу имеющихся молекул, поэтому скорость реакции должна быть пропорциональна концентрации реагирующих веществ в степени стехиометрического коэффициента:
v = k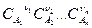 ,
,
где v – скорость химической реакции; k – константа скорости химической реакции.
Это выражение иногда называют основным постулатом химической кинетики.
Физический смысл коэффициента k можно установить, если принять все концентрации равными единице:
СА1 = СА2 = …. = САп = 1.
При этом условии v = k, т.е. константа скорости химической реакции есть скорость реакции при условии, что концентрации реагирующих веществ равны единице. Эту величину иногда называют удельной скоростью химической реакции.
Обычно скорость данной химической реакции при постоянных внешних условиях не остается постоянной, а изменяется во времени. По мере израсходования исходных веществ скорость процесса уменьшается.
Поэтому численные значения скорости реакции будут различными в зависимости от того, для какого момента или промежутка времени рассматривается изменение концентраций.
Существует понятие средней скорости реакции:
v = ±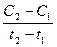 .
.
И истинной скорости химической реакции:
v = ±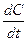 .
.
Скорость реакции всегда считается положительной. Производная 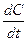 может быть как положительной, так и отрицательной, в зависимости от подстановки концентраций исходных веществ или продуктов реакции. Если скорость определяется по концентрации исходных веществ, то перед производной ставят знак минус, если по концентрации продуктов реакции – знак плюс.
может быть как положительной, так и отрицательной, в зависимости от подстановки концентраций исходных веществ или продуктов реакции. Если скорость определяется по концентрации исходных веществ, то перед производной ставят знак минус, если по концентрации продуктов реакции – знак плюс.
| <== предыдущая страница | | | следующая страница ==> |
| Метода защиты металлов от коррозии | | | НЕОБРАТИМАЯ РЕАКЦИЯ ПЕРВОГО ПОРЯДКА |
Дата добавления: 2014-03-11; просмотров: 289; Нарушение авторских прав

Мы поможем в написании ваших работ!