
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Химические источники тока
Химические источники тока (ХИТ) – это системы для непосредственного превращения химической энергии окислительно-восстановительной реакции в электрическую. В настоящее время существует очень большое число типов ХИТ: гальванические, комбинированные, резервные, топливные элементы, аккумуляторы. Основной отличительной особенностью аккумуляторов является то, что реакции, протекающие в них, являются обратимыми, поэтому их можно заряжать и использовать не один раз. Условное обозначение ХИТ:
(а) / электролит // электролит / (к)
или (а) / электролит / (к) ,
где (а) – материал анода (электрода, на котором идет процесс окисления);
(к) – материал катода (электрода, на котором идет процесс восстановления);
/ – поверхность раздела электролит - раствор или расплав электролита;
// – поверхности раздела пространственно удалены друг от друга. При работе источников тока в них протекают достаточно сложные, многостадийные процессы. Условия, необходимые для получения электрического тока в ХИТ:
· ХИТ должен содержать два электрода с различными потенциалами;
· процессы окисления и восстановления должны быть пространственно разделены;
· внешняя и внутренняя цепи должны быть замкнуты.
Далее будут рассмотрены примеры только гальванических элементов.
Пример 1. Схема гальванического элемента:
Zn / ZnSO4 // H2SO4 / H2 (Pt) .
Слева – цинковый электрод, погружённый в раствор сульфата цинка, справа – стандартный водородный электрод (платиновая пластина в растворе серной кислоты). Условия работы гальванического элемента будем считать стандартными, т.е. потенциал электрода из цинка 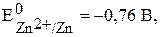 потенциал водородного (платинового) электрода
потенциал водородного (платинового) электрода 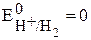 В. Условие самопроизвольного протекания окислительно-восстановительной реакции -
В. Условие самопроизвольного протекания окислительно-восстановительной реакции -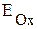 >
> 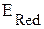 , следовательно, на правом электроде будет идти полуреакция восстановления (платина - катод), а на левом – окисления (цинк - анод):
, следовательно, на правом электроде будет идти полуреакция восстановления (платина - катод), а на левом – окисления (цинк - анод):
· анодный процесс - Zn - 2ē = Zn2+;
· катодный процесс - 2Н+ + 2ē = Н2 .
Ионное и молекулярное уравнения реакции, на которой основана работа гальванического элемента:
Zn + 2Н+ = Zn2+ + Н2 ; Zn + Н2SO4 = ZnSO4 + Н2 .
Электроны, отдаваемые цинком, по внешней цепи перемещаются к катоду, а в противоположном направлении, по внутренней цепи, перемещаются отрицательно заряженные ионы SO42—:

 ē
ē
(-) (+)
(а) Zn / ZnSO4 // H2SO4 / H2 (Pt) (к)

 SO42—
SO42—
 |
ЭДС любого ХИТ рассчитывается как разность 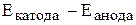 =
=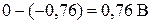 . Значение ЭДС должно быть больше нуля.
. Значение ЭДС должно быть больше нуля.
Пример 2. Схема гальванического элемента:
Al / Al2(SO4)3 0,005M // KСlO3; KCl; H2SO4 / (C)
Слева – алюминиевый электрод, погружённный в раствор сульфата алюминия с концентрацией 0,005 моль/л (при обозначении молярной концентрации обозначение размерности моль/л часто заменяют буквой М), справа – графитовый электрод в растворе двух солей при стандартных условиях. Потенциал алюминиевого электрода необходимо рассчитать по уравнению (2):
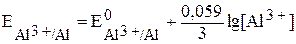 .
.
В условиях указана концентрация соли, ионы алюминия образуются при её диссоциации: Al2(SO4)3 = 2Al3+ + 3SO42—, поэтому [Al3+] = =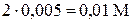 . Таким образом,
. Таким образом,
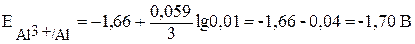 .
.
Потенциал на графитовом электроде равен стандартному потенциалу окислительно-восстановительной пары СlO3—/Cl—: 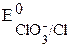 =1,45 В.
=1,45 В.

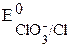 >
> 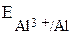 , т.е. в левом полуэлементе находится восстановитель (идёт полуреакция окисления, алюминий – анод), в правом – окислитель (идёт полуреакция восстановления, графитовый электрод – анод).
, т.е. в левом полуэлементе находится восстановитель (идёт полуреакция окисления, алюминий – анод), в правом – окислитель (идёт полуреакция восстановления, графитовый электрод – анод).
Анодный процесс Al - 3ē = Al3+ 2
катодный процесс - СlO3— + 6H+ + 6ē = Cl— + 3H2O 1
Ионное и молекулярное уравнения реакции:
2Al + ClO3— + 6H+ = 2Al3+ + Cl— + 3H2O,
2Al + KClO3 + 3H2SO4 = Al2(SO4)3 + KCl + 3H2O.
Условная схема работы гальванического элемента:
ē
 |
(-) (+)
(а) Al / Al2(SO4)3 // KСlO3; KCl; H2SO4 / (C) (к)
 SO42—
SO42—
 |
ЭДС = 1,45 – (-1,70) = 3,15 В.
| <== предыдущая страница | | | следующая страница ==> |
| Электродные потенциалы. Направление ОВР | | | КОРРОЗИЯ МЕТАЛЛОВ |
Дата добавления: 2014-02-27; просмотров: 414; Нарушение авторских прав

Мы поможем в написании ваших работ!