
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
КОРРОЗИЯ МЕТАЛЛОВ
Коррозия - процесс самопроизвольного нежелательного разрушения металлов при взаимодействии с компонентами окружающей среды, выполняющими роль окислителей. В литературе по коррозии окислители принято называть деполяризаторами. Процессы коррозии сложные, очень часто многостадийные. В пределах данного курса они будут рассмотрены в упрощенной форме.
Рассмотрим реакции окисления металлов при взаимодействии их с растворами кислот, щелочей и водой. Для решения вопроса о возможности окисления металла необходимо сравнить потенциалы окислителя (Ox) и металла (Red) в рассматриваемой среде. Электродные потенциалы некоторых металлов, а также водорода и кислорода в кислой, нейтральной и щелочной среде приведены в табл. 4. Таблица 4
| Среда | |||||
| кислая (рН=0) | нейтральная (рН=7) | щелочная (рН=14) | |||
| Red/Ox пара | Е0, В | Red/Ox пара | Е, В | Red/Ox пара | Е0, В |
| 2H+/H2 | 0,00 | 2H2O/H2 | - 0,41 | 2H2O/H2 | - 0,83 |
| O2/2H2O | + 1,22 | O2/4OH- | + 0,81 | O2/4OH- | + 0,40 |
| Mg2+/Mg | - 2,36 | Mg(OH)2/Mg | - 2,38 | Mg(OH)2/Mg | - 2,69 |
| Al3+/Al | - 1,66 | Al(OH)3/Al | - 1,88 | AlO2-/Al | - 2,36 |
| Zn2+/Zn | - 0,76 | Zn(OH)2/Zn | - 0,81 | ZnO22-/Zn | - 1,22 |
| Cr3+/Cr | - 0,74 | Cr(OH)3/Cr | - 0,93 | CrO2-/Cr | - 1,32 |
| Fe2+/Fe | - 0,44 | Fe(OH)2/Fe | - 0,46 | Fe(OH)2/Fe | - 0,87 |
| Cd2+/Cd | - 0,40 | Cd(OH)2/Cd | - 0,41 | Cd(OH)2/Cd | - 0,82 |
| Ni2+/Ni | - 0,25 | Ni(OH)2/Ni | - 0,30 | Ni(OH)2/Ni | - 0,72 |
| Sn2+/Sn | - 0,14 | Sn(OH)2/Sn | - 0,50 | SnO22-/Sn | - 0,91 |
| Cu2+/Cu | +0,34 | Cu(OH)2/Cu | + 0,19 | Cu(OH)2/Cu | - 0,22 |
Если выполняется условие самопроизвольного протекания окислительно-восстановительной реакции, т.е. 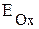 >
> 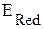 , то процесс коррозии может начаться самопроизвольно. Написание уравнений будем выполнять по правилам составления уравнений ОВР (см. подраздел 6.2).
, то процесс коррозии может начаться самопроизвольно. Написание уравнений будем выполнять по правилам составления уравнений ОВР (см. подраздел 6.2).
| <== предыдущая страница | | | следующая страница ==> |
| Химические источники тока | | | Взаимодействие металлов с кислотами |
Дата добавления: 2014-02-27; просмотров: 345; Нарушение авторских прав

Мы поможем в написании ваших работ!