
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
Целью защиты металлов от коррозии является торможение или полное устранение анодного окисления металлов. Выбор способа защиты определяется его целесообразностью и (или) экономической эффективностью.
Легирование. При изготовлении оборудования применяются коррозионно-стойкие конструкционные материалы. Повышение коррозионной стойкости менее стойкого материала достигается путем легирования - приготовления сплавов, получаемых при совместном плавлении основного менее стойкого материала с более стойкими материалами. Эти добавочные вещества, находясь в поверхностных слоях сплава образуют на поверхности прочные оксидные пленки, препятствующие окислению основного металла. Примерами легирующих добавок являются Al, Si, Ni, Cr, Mo, W, Ti.
Ингибиторы коррозии.Некоторые вещества (неорганические -NaNO3, K2Cr2O7 или органические - уротропин, формалин, ПАВ) при введении их в коррозийную среду в незначительном количестве заметно снижают скорость электрохимической коррозии металла. Такие вещества называются ингибиторами коррозии. Они могут окислять поверхность металла, образуя защитную оксидную пленку, или адсорбироваться на поверхности металла в виде мономолекулярной пленки, которая полностью или частично изолирует поверхность металла и препятствует подходу окислителя.
Защитные покрытия. Защитные покрытия представляют собой слои, нанесенные на поверхность металла с целью его изоляции от окружающей среды. Покрытия, защищающие основной металл изделия, должны быть сплошными, плотными, иметь одинаковую толщину на разных участках, прочное сцепление с поверхностью и коэффициент теплового расширения примерно такой же, как у основного металла.
Защитные покрытия бывают металлические и неметаллические.
Неметаллические покрытия. Эти покрытия включают в себя:
- лаки, краски, грунтовки, шпатлевки;
- полимерные покрытия;
- эмали;
- оксиды;
- соли металов.
Металлические покрытия.Покрытия называются анодными, если потенциал металла покрытия меньше потенциала металла защищаемого изделия. При нарушении сплошности анодного покрытия образуется коррозионный элемент: «металл анодного покрытия М1 |электролит| металл изделия М2 », в котором протекает окисление металла М1. При этом нарушенное анодное покрытие защищает изделие.
Покрытия называются катодными, если потенциал металла покрытия больше потенциала металла изделия. В местах нарушения покрытия образуется коррозионный элемент: «металл изделия М2 |электролит| металл катодного покрытия М3 » и происходит окисление металла М2, изделие разрушается. Поэтому требования к сплошности катодного покрытия должны быть более строгими по сравнению с требованиями к анодным покрытиям.
Электрохимическая защита – перевод металла в коррозионно-устойчивое состояние путем торможения катодных и анодных рекций коррозионного процесса электрохимическими методами. Электрохимическаязащита подразделяется на катодную электрозащиту, анодную электрозащиту и протекторную защиту. Во всех случаях для создания хорошо проводящей электрический ток среды в раствор добавляется индифферентная (не участвующая в электродных процессах) соль, например, Na2SO4.
Катодная электрозащита. Суть катодной защиты заключается в том, что защищаемое изделие подключается к отрицательному полюсу источника электрического напряжения, т.о. становится катодом. В качестве противоэлектрода используется металлический лом или графит. Защита осуществляется благодаря смещению потенциала металла изделия в отрицательную сторону. Так как потенциал защищаемого изделия становится меньше потенциала противоэлектрода, на поверхности защищенного изделия протекают только процессы восстановления окислителей, а процессы окисления совершаются на поверхности противоэлектрода - анода. В такой электрохимической системе реализуются процессы, характерные для электролиза.
Защищаемое изделие является катодом, на его поверхности может выделяться газообразный водород:
K: 2H2O + 2 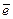 = H2 + 2OH– (при рН ≥ 7).
= H2 + 2OH– (при рН ≥ 7).
Вид процесса окисления зависит от материала противоэлектрода. На графитовом аноде может выделяться кислород,
А «C»: 4 OH– - 4 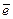 = O2 + 2H2O (при рН ≥ 7).
= O2 + 2H2O (при рН ≥ 7).
На железном аноде происходит окисление (растворение) материала анода,
A «Fe»: Fe - 2 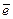 = Fe2+ .
= Fe2+ .
Анодная электрозащита. Анодная защита конструкционно подобна катодной, с тем различием, что защищаемое изделие делается анодом. Вследствие этого анодная защита применима только для металлов, способных пассивироваться. На поверхности защищаемого металла образуется защитная гидроксидная или оксидная пленка, резко снижающая скорость окисления металла.
Протекторная защита. Суть протекторной защиты состоит в создании гальванического элемента, в котором защищаемое изделие является катодом. Для этого его подсоединяют к металлу с меньшим значением стандартного электродного потенциала. При этом окисляется только металл этого анода, защищая основной металл. Подобнце электроды называются протекторами или жертвенными электродами.
Защита от коррозии изменением состава среды.В ограниченных объемах химических аппаратов или емкостей для хранения можно проводить обработку коррозионной среды для уменьшения ее агрессивности различными методами.
1. Деаэрация–уменьшение концентрации кислорода с помощью пропускания инертных газов, кипячения, а также введения в среду веществ, реагирующих с кислородом, электрохимическим восстановлением.
2. Нейтрализация– уменьшение концентрации ионов водорода с помощью негашеной извести
2H+ + CaO = Ca2++H2O
или щелочи
Н+ + OH– = H2O.
3. Ингибирование–введение веществ, замедляющих коррозионный процесс.
Пример 3. Предложите катодное металлическое покрытие для железа при рН = 5. Составьте электрохимическую схему коррозионного элемента, образующегося при нарушении целостности покрытия, запишите уравнения анодной и катодной реакций
Решение. В качестве катодного покрытия можно выбрать любой металл со стандартным потенциалом, большим 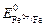 = -0,44 В. Например, можно взять медь, у которой
= -0,44 В. Например, можно взять медь, у которой 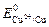 = 0,337 В.
= 0,337 В.
Электрохимическая схема коррозионного элемента
А (-) Fe | H+| О2 | Cu (+) К.
Окисление железа протекает по реакции:
Fe - 2 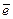 = Fe2+ .
= Fe2+ .
Уравнения возможных процессов восстановления на меди ионов водорода и кислорода:
2H+ + 2e– = H2,
O2 + 4H+ + 4e– = 2H2O.
Пример 4. Предложите вариант протекторной защиты для кобальта при рН = 9. Составьте электрохимическую схему коррозионного элемента, образующегося при нарушении целостности покрытия, запишите уравнения анодной и катодной реакций.
Решение. В качестве протектора можно выбрать любой металл со стандартным потенциалом, меньшим 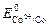 = -0,277 В. Например, можно взять хром, у которого
= -0,277 В. Например, можно взять хром, у которого 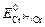 = 0,744 В.
= 0,744 В.
Электрохимическая схема коррозионного элемента
А (-) Co | H2O | О2 | Cr (+) К
Окисление хрома протекает по реакции:
Cr - 3e– = Cr3+.
Уравнения возможных процессов восстановления на кобальте ионов водорода и кислорода:
2H+ + 2e– = H2-,
O2 + 2H2O + 4e– = 4OH–.
Пример 5. Предложите вариант катодной электрозащиты для свинца при 1) рН = 3, 2) рН = 7. Запишите электрохимическую систему, уравнения анодной и катодной реакций.
| <== предыдущая страница | | | следующая страница ==> |
| СКОРОСТЬ КОРРОЗИИ | | | Решение. 1) В качестве противоэлектрода возьмем железо |
Дата добавления: 2014-11-01; просмотров: 1004; Нарушение авторских прав

Мы поможем в написании ваших работ!