
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
СКОРОСТЬ КОРРОЗИИ
ВЛИЯНИЕ СОСТАВА СРЕДЫ НА
Влияние среды на протекание электрохимической коррозии. Диаграмма Е – pH указывает на возможность или невозможность коррозии. Однако если коррозия возможна, она может протекать со значительной скоростью, а может протекать и настолько медленно, что становится практически незаметной. Для многих металлов скорость коррозии зависит от состава среды, с которой контактирует металл, особенно от рН раствора.
Можно выделить четыре группы металлов, имеющие разную форму зависимости скорости коррозии vкор от рН. Кривые Vкор - рН приведены на рис. 4.3.
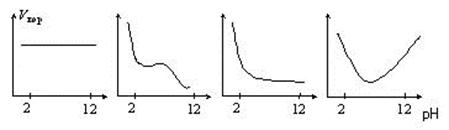 а б в г
а б в г
Рис. 4.3. Зависимость скорости vкор от рН для пяти групп металлов
Группа 1 – металлы, коррозионно нестойкие в любых средах. Это щелочные и некоторые другие металлы (рис. 4.3, а).
Группа 2 – металлы, нестойкие в кислой среде, но коррозионная стойкость которых увеличивается в нейтральной среде и наиболее при рН = 12 – 14 вследствие образования пленки гидроксида (металлы Mg, Mn, Fe, Cr, Cu), (рис. 4.3, б). На поверхности металла при этом протекают реакции типа (4.5.) – (4.6).
Группа 3 – металлы, скорость коррозии которых значительна в кислой среде и мала в нейтральной и щелочной средах, так как образуются защитные пленки оксидов и гидроксидов. При этом на металлах, например, Ni, Co, Cd, (pис. 4.9,в) протекают реакции, аналогичные (4.3.) – (4.7).
Группа 4 – амфотерные металлы (Zn, Al, Sn, Pb, Bi, Be), их оксиды и гидроксиды устойчивы в нейтральной среде, но растворимы в кислотах и щелочах:
Zn(OH)2 + 2 H+ = Zn2+ + 2 H2O
ZnO + 2OH– = ZnO22– + H2O
Скорость коррозии этих металлов минимальна в нейтральной среде и возрастает в кислой и щелочной среде (pис. 4.3, г).
Пассивность металлов. На ряде металлов формируются плотные пленки гидроксидов и оксидов, которые сильно тормозят подход окислителя к поверхности металла. В этом случае скорость коррозии значительно замедляется и может стать практически нулевой. Явление резкого уменьшения скорости окисления металла вследствие образования на поверхности гидроксидных или оксидных труднорастворимых пленок называется пассивацией поверхности металла. Пассивация поверхности может быть усилена подключением к положительному полюсу внешнего источника напряжения.
| <== предыдущая страница | | | следующая страница ==> |
| IV. Мнение автора по рациональному использованию бюджетных средств муниципального образования | | | ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ |
Дата добавления: 2014-11-01; просмотров: 440; Нарушение авторских прав

Мы поможем в написании ваших работ!