
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Взаимодействие металлов с кислотами
Кислоты можно разбить на две группы:
· кислоты, в которых окислителем являются ионы водорода (HCl, CН3СООН, H2SO4 разбавленная и др.),
· кислоты, в которых окислителем служат анионы (H2SO4 конц., HNO3).
· Взаимодействие металлов с кислотами, в которых окислитель - ион водорода.
В растворах таких кислот стандартный потенциал окислителя 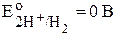 . C ними реагируют металлы, потенциалы которых отрицательны. Например, цинк растворяется в разбавленной серной кислоте с выделением водорода (
. C ними реагируют металлы, потенциалы которых отрицательны. Например, цинк растворяется в разбавленной серной кислоте с выделением водорода (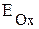 >
> 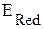 ):
):
Zn + H2SO4 разб. = ZnSO4 + H2
Red Ox
Реакция взаимодействия меди с хлороводородной (соляной) и разбавленной серной кислотами невозможна, так как 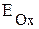 <
< 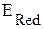 :
:
 В;
В; 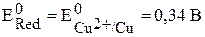 .
.
· Взаимодействие металлов с кислотами, в которых окислитель - анион кислоты.
В концентрированной серной и разбавленной азотной кислотах продукты восстановления аниона зависят от активности металла. По активности металлы можно условно разделить на три группы:
Li Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Bi Cu Ag Hg Au
 |
активные средней активности малоактивные
Условная схема взаимодействия металлов (М) с концентрированной серной кислотой: активные металлы

 H2S
H2S
металлы средней активности

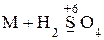 конц. ® сульфат М + H2O + S
конц. ® сульфат М + H2O + S
Ox малоактивные металлы
 SO2
SO2
Пример. 4Mn + 5H2SO4 конц. = 4MnSO4 + H2S + 4H2O.
Условная схема взаимодействия металлов с разбавленной азотной кислотой:
активные металлы

 NH4NO3
NH4NO3
металлы средней активности
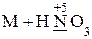 разб. ® нитрат М + H2O + N2, N2O
разб. ® нитрат М + H2O + N2, N2O
Ox малоактивные металлы
 NO
NO
Пример. 3Cu + 8HNO3 разб. = 3Cu(NO3)2 + 2NO + 4H2O.
При взаимодействии металлов с концентрированной азотной кислотой, независимо от активности металла, образуется NO2:
М + HNO3конц. ® нитрат М + NO2 + H2O.
Пример. Zn + 4HNO3 конц. = Zn(NO3)2 + 2NO2 + 2H2O.
На практике реакции с этими кислотами происходят гораздо сложнее, продукты взаимодействия зависят от температуры, концентрации кислоты. Некоторые металлы в концентрированных кислотах пассивируются (т.е. процесс коррозии резко тормозится, вплоть до полного прекращения), но, в первом приближении, можно ограничиться такими схемами. Важно помнить, что в этих случаях водород не выделяется.
| <== предыдущая страница | | | следующая страница ==> |
| КОРРОЗИЯ МЕТАЛЛОВ | | | Взаимодействие металлов с водой и растворами щелочей |
Дата добавления: 2014-02-27; просмотров: 701; Нарушение авторских прав

Мы поможем в написании ваших работ!