
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Аналитические реакции анионов III группы
9.3.1 Аналитические реакции аниона нитрита NO2−
Анион нитрита является анионом слабой одноосновной азотистой кислоты (HNO2; рК = 3,29), которая в водных растворах неустойчива и разлагается:
2 HNO2 « N2O3 + H2O; N2O3 « NO + NO2.
Нитрит-ион в растворе подвергается гидролизу, обладает окислительными и восстановительными свойствами.
1.Реакция с сильными кислотами. Нитрит-ион под действием разбавленных сильных кислот переходит в азотистую кислоту HNO2, которая затем разлагается с выделением оксида азота (IV) бурого цвета.
NO2- + H+ « HNO2; (9.35)
2 HNO2 « N2O3 + H2O « NO + NO2 + H2O . (9.36)
2.Реакция с иодидом калия (нитрит-ион - окислитель). Нитрит-ион в кислой среде (HCl; H2SO4; CH3COOH) окисляет ионы йодида до свободного йода (см. уравнение 9.33). Выделяющийся свободный йод окрашивает раствор в желто-коричневый цвет. Данной реакции мешают другие окислители.
3.Реакция с перманганатом калия (нитрит-ион - восстановитель). Нитрит-ион в сернокислой среде окисляется до нитрата, а раствор перманганата обесцвечивается:
5 NO2- + 2 MnO4- + 6 H+ ® 5 NO3- + 2 Mn2+ + 3 H2O. (9.37)
Проведению данной реакции мешают другие анионы-восстановители (SO32-; I-; Br-).
4.Реакция образования гексанитрокобальтата (III) калия K3[Co(NO2)6]. При взаимодействии солей кобальта и нитрита калия в уксуснокислой среде образуется желтый кристаллический осадок:
a).Co2+ + NO2- + 2 CH3COOH ® NO + 2 CH3COO- + Co3+ + H2O;
б).Co3+ + 6 NO2- ® [Co(NO2)6]3-;
в).[Co(NO2)6]3- + 3 K+ ® K3[Co(NO2)6]¯. (9.38)
желтый осадок
9.3.2 Аналитические реакции аниона нитрата NO3−
Анион нитрата NO3− - анион одноосновной сильной азотной кислоты HNO3. В водных растворах нитрат-анион бесцветный, не подвергается гидролизу. Нитраты металлов хорошо растворимы в воде.
1.Реакция с дифениламином. Нитрат-анион при взаимодействии с дифениламином в присутствии концентрированной серной кислоты переводит данный органический реагент в продукт его окисления – синий дифенилдифенохинондиимин.
Вначале происходит необратимое окисление дифениламина в дифенилбензидин:
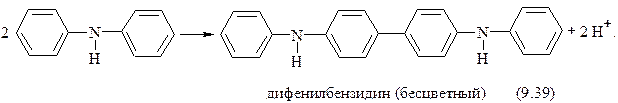
Затем происходит обратимое окисление молекулы бензидина присутствующим окислителем (NO3−) до окрашенного в синий цвет дифенилдифенохинондиимина:
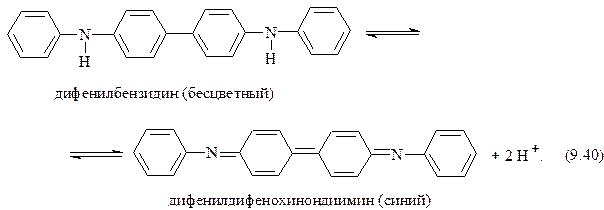
В результате раствор окрашивается в синий цвет. Образовавшийся синий продукт окисления далее необратимо разрушается до продуктов реакции бурого, а затем желтого цвета. Реакцию проводят в фарфоровой чашке или пробирке с минимальным объемом исследуемого раствора.
9.3.3 Аналитические реакции аниона ацетата СН3СОО−
Ацетат-анион СН3СОО− - анион слабой одноосновной уксусной кислоты СН3СООН (рК = 4,76); в водных растворах бесцветен, подвергается гидролизу, не обладает окислительно-восстановительными свойствами. Большинство солей-ацетатов хорошо растворимы в воде.
1.Реакция с хлоридом железа (III). Анион СН3СОО− образует с катионами железа Fe3+ при рН 5-8 растворимое соединение – ацетат или оксиацетат железа (III) темно-красного цвета. В водном растворе соединение частично гидролизуется; подкисление раствора кислотами (HCl, H2SO4) подавляет гидролиз и приводит к исчезновению темно-красной окраски.
Fe3+ + 3 СН3СОО− → Fe(СН3СОО)3. (9.41)
темно-красн. р-р
При кипячении первоначально полученного раствора образуется темно-красный осадок основного ацетата железа (III):
tº
Fe(СН3СОО)3 + 2 H2O —→ Fe(OH)2CH3COO↓ + 2 СН3СООН. (9.42)
темно-красный ос.
Осадок выпадает только при избытке ионов ацетата в растворе. В зависимости от соотношения катионов железа (III) и анионов ацетата состав осадка может меняться и соответствовать формулам: FeOH(СН3СОО)2; Fe3(OH)2O3СН3СОО; Fe3O(OH)( СН3СОО)6; Fe3(OH)2(СН3СОО)7.
Проведению данной реакции мешают анионы: CO32−; SO32−; PO43−; [Fe(CN)6]4−; SCN−; I−.
2.Реакция с серной кислотой. Анион ацетата в сильно кислой среде переходит в уксусную кислоту, которую можно определить по запаху или с помощью индикаторной бумаги:
tº
СН3СОО− + Н+ —→ СН3СООН. (9.43)
Данной реакции мешают анионы NO2−; SO32−, также выделяющие в среде серной кислоты газообразные продукты с характерным резким запахом.
Продукты основных аналитических реакций анионов третьей группы представлены в таблице 9.5.
Таблица 9.5.
Продукты некоторых аналитических реакций анионов III группы
| Реагенты | Продукты аналитических реакций анионов | ||
| NO2- | NO3- | CH3COO- | |
| H2SO4 (конц.) | NO2 | - | CH3COOH (при нагревании) |
| KMnO4 + H+ | Обесцвечивание р-ра: Mn2++ NO3-. | - | - |
| KI + H2SO4 | I2¯ +NO. | - | - |
| Дифениламин + H2SO4. | - | Синее окрашивание. | - |
| FeCl3 | - | - | Красно-бурый раствор: Fe(CH3COO)3. |
| <== предыдущая страница | | | следующая страница ==> |
| Аналитические реакции анионов II группы | | | Анализ смеси анионов I-III аналитических групп |
Дата добавления: 2014-11-14; просмотров: 732; Нарушение авторских прав

Мы поможем в написании ваших работ!