
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Метод прямой потенциометрии
Прямая потенциометрия – метод, позволяющий определить концентрацию вещества в электролите по величине потенциала электрода в растворе известного качественного состава. Прямая потенциометрия основана на измерении ЭДС (электродвижущей силы) электрохимической цепи, составленной из индикаторного электрода и электрода сравнения, соединенных между собой при помощи солевого мостика.
В качестве индикаторного электрода может быть использован электрод, в котором электронный проводник – металл, контактирует с ионным проводником (раствором электролита), содержащим простые ионы этого же металла. Металл является восстановленной формой вещества, участвующего в электродной реакции, а ионы – окисленной. Примером такого электрода может служить цинковый электрод, электродная реакция для которого может быть записана следующим образом:
Zn2+ + 2e = Zn, (Б.1)
а уравнение Нернста для электродного потенциала:
E 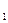 = E
= E 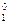 +
+ 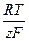 ln
ln 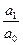 , (2.1)
, (2.1)
где E 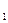 – значение потенциала цинкового электрода относительно стандартного водородного электрода (СВЭ), В; E
– значение потенциала цинкового электрода относительно стандартного водородного электрода (СВЭ), В; E 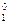 – значение стандартного потенциала цинкового электрода относительно (СВЭ), В; R – универсальная газовая постоянная, равная 8,314 Дж×(моль×К)-1; T – температура, K; z – число электронов, участвующих в реакции, (Б.1) z = 2; F – постоянная Фарадея, равная 96485 Кл×(г-экв)-1 a
– значение стандартного потенциала цинкового электрода относительно (СВЭ), В; R – универсальная газовая постоянная, равная 8,314 Дж×(моль×К)-1; T – температура, K; z – число электронов, участвующих в реакции, (Б.1) z = 2; F – постоянная Фарадея, равная 96485 Кл×(г-экв)-1 a 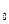 – активность цинка в сплаве; a
– активность цинка в сплаве; a 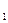 – активность ионов цинка в растворе.
– активность ионов цинка в растворе.
Если раствор разбавленный, а цйинк – чистый металл а 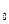 = 1, то уравнение для электродного потенциала цинкового электрода может быть записано следующим образом:
= 1, то уравнение для электродного потенциала цинкового электрода может быть записано следующим образом:
E 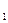 = E
= E 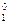 +
+ 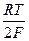 lnС1, (2.2)
lnС1, (2.2)
где С1 – концентрация ионов цинка (моль×л-1).
Как следует из уравнения (2.2), электродный потенциал цинкового электрода зависит от концентрации ионов цинка в растворе. В координатах Е1 – lnC1 эта зависимость представляет собой прямую линию. Цинковый электрод схематично можно изобразить так:
Zn | Zn2+, (Б.2)
где Zn – цинк, Zn2+ – раствор электролита, содержащий ионы цинка, вертикальная линия указывает на границу раздела металл – электролит.
В лабораторном практикуме для удобства составления электрохимических цепей собирают полуэлементы, состоящие из электронного проводника – металла 1, погруженного в раствор электролита 2, помещенного в сосуд 3 с сифоном 4, краном 5, патрубком 6, который герметично закрыт пробкой 7 (рис. 6).
В качестве электрода сравнения может быть использован хлорсеребряный электрод, в котором электронный проводник – серебро, покрыт слоем его трудно растворимого соединения (хлоридом серебра), а ионный проводник (раствор электролита)в своем составе содержит анионы трудно растворимого соединения (ионы Cl-). Серебро является восстановленной формой вещества, участвующего в электродной реакции, а хлорид серебра – его окисленной формой. Хлорсеребряный электрод можно схематично изобразить так:
Ag, AgCl | Cl-, (Б.3)
где Ag – серебро, AgCl – хлорид серебра, на поверхности серебра, Cl- – электролит, содержащий ионы хлора, вертикальная линия указывает на границу раздела хлорид серебра – электролит.
Электродную реакцию –
AgCl + e = Ag + Cl-, (Б.4)
а уравнение для электродного потенциала:
E 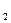 = E
= E 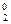 +
+ 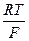 ln
ln 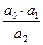 (2.3)
(2.3)
где E 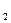 – значение потенциала хлорсеребряного электрода относительно СВЭ, В; Е
– значение потенциала хлорсеребряного электрода относительно СВЭ, В; Е 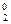 – значение стандартного потенциала хлорсеребряного электрода относительно СВЭ, В; a
– значение стандартного потенциала хлорсеребряного электрода относительно СВЭ, В; a 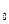 – активность серебра; a
– активность серебра; a 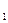 – активность ионов хлора в растворе, а
– активность ионов хлора в растворе, а 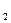 – активность хлорида серебра, равная единице, поскольку хлорид серебра – чистое вещество.
– активность хлорида серебра, равная единице, поскольку хлорид серебра – чистое вещество.
Поскольку взят чистый металл a 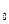 = 1`, хлорид серебра – чистое вещество а
= 1`, хлорид серебра – чистое вещество а 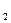 = 1, тогда потенциал электрода зависит только от активности ионов хлора в растворе:
= 1, тогда потенциал электрода зависит только от активности ионов хлора в растворе:
E 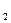 = E
= E 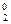 +
+ 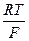 ln
ln 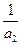 (2.4)
(2.4)
Если в качестве электролита, содержащего ионы хлора, использовать насыщенный раствор хлорида калия, то потенциал хлорсеребряного электрода будет стабильным и при температуре (20 ± 2)оС равен 0.201 В относительно СВЭ. Конструкция наиболее распространенного варианта хлорсеребряного электрода изображена на рис. 7.
Солевой мостик представляет собой изогнутую трубку, заполненую гелем, на основе раствора электролита, например, хлорида калия, содержащим желатин или агар-агат. Если по каким-то причинам применение KCl невозможно, например, в случае контактирования мостика с электролитом, содержащим соли серебра, что привело бы к образованию осадка хлорида серебра, то используют мостик, заполненным гелем, содержащим, например, раствор нитрата аммония.
Для измерения потенциала металлического электрода относительно хлорсеребряного электрода сравнения составляют электрохимическую цепь (систему) из исследуемого электрода и электрода сравнения, которую, схематично можно изобразить следующим образом:
(-) Zn | Zn2+ || KCl | AgCl, Ag (+), (Б.5)
где две вертикальные линии обозначают солевой мостик, подключают к концам цепи (Б.5) потенциометр или катодный вольтметр (стрелочный или цифровой) с высоким входным сопротивлением (109 – 1012 Ом) и измеряют электродвижущую силу (ЭДС) цепи (Б.5). ЭДС цепи (Б.5) DЕ равна разности потенциалов хлорсеребряного Е2 и цинкового Е1 электродов:
DЕ = Е2 – Е1 (2.5)
Принцип действия и порядок работы на потенциометре или катодном вольтметре излагаются в прилагаемых к этим приборам инструкциях.
Работа 3. Определение концентрации электролита методом прямой
потенциометрии
Выполнение работы начинают с приготовления растворов заданных составов путем отбора при помощи бюретки соответствующего количества исходного раствора электролита с концентрацией 1 моль×л-1 и разбавления его в мерной колбе объемом 100 мл.
Поверхность металлического электрода обрабатывают тонкой наждачной бумагой до равномерного блеска, промывают дистиллированной водой, обтирают фильтровальной бумагой и промывают в этиловом спирте для обезжиривания.
Затем собирают полуэлемент, для чего промывают сосуд 3 (рис. 6) дисциллированной водой, ополаскивают его раствором, который будет служить электролитом, и плотно закрывают пробкой 7, в которую вставлен электронный проводник 1. Надевают грушу на патрубок 6, открывают кран 5, выдувают из груши воздух и закрывают кран. Погрузив сифон 4 в стакан с раствором электролита, открывают кран 5 и засасывают электролит 2 в сосуд, следя за тем, чтобы в сифоне не было пузырьков воздуха, после чего закрывают кран. Если полуэлемент собран герметично, то капли электролита на кончике сифона не образуются. При некачественной сборке полуэлемента электролит из сосуда будет вытекать.
При составлении электрохимической цепи, например (Б.5), сифон полуэлемента погружают в стакан с раствором электролита, которым заполнен полуэлемент, хлорсеребряный электрод погружают его в стакан с насыщенным раствором хлорида калия и соединяют электролиты солевым мостиком. Подключают к концам цепи (Б.5) потенциометр или катодный вольтметр и проводят измерение ЭДС. При измерении ЭДС необходимо записывать знак потенциала исследуемого электрода относительно электрода сравнения. Зная потенциал хлорсеребряного электрода относительно стандартного водородного электрода сравнения, рассчитывают потенциалы исследуемых электродов относительно СВЭ и сравнивают полученные значения потенциалов с величинами, рассчитанными по уравнению Нернста (2.3). После чего строят калибровочный график – зависимость Е = f(lnC1), которая обычно представляет собой прямую линию. Затем проводят измерения с раствором, выданным преподавателем, определяют концентрацию электролита и проводят анализ полученных результатов.
| <== предыдущая страница | | | следующая страница ==> |
| Работа 2. Определение концентрации гидроксида натрия в растворе методом кондуктометрического титрования | | | Метод потенциометрического титрования |
Дата добавления: 2014-11-15; просмотров: 451; Нарушение авторских прав

Мы поможем в написании ваших работ!