
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Биогенез хлоропластов подвергается контролю и регуляции со стороны внешних и внутренних факторов. Выделяют световую (фоторегуляция), гормональную и генетическую регуляции
Для транспорта в хлоропласты на N-конце белков должен находиться сигнальный пептид, состоящий из 40 — 50 аминокислот. Белок транспортируется в строму хлоропластов в местах «слипания» их мембран. Транспорт требует энергии в виде АТФ.
Белки кодируемые в пластидном геноме
Хлоропласты высших растений содержат около 40 генов, кодирующие «рабочие» белки пластид. У разных организмов набор генов хлоропластного генома может быть различным. В целом можно отметить следующую закономерность: функциональные белки фотосинтетического аппарата чаще кодируются в геноме хлоропластов, тогда как регуляторные или «дополнительные» — в ядерном геноме. Например, в хлоропластом геноме кодируются основные белки реакционных центров обеих фотосистем, апопротеины цитохромов и ά и β-субъединицы АТФ-синтазы, большая (каталитическая) субъединица рибулезобисфосфаткарбоксилазы (Рубиско). Под ядерным генетическим контролем находится весь спектр антенных хлорофиллсвязывающих белков, малая (регуляторная) субъединица Rubisco.
ТРАНСПОРТ ЦИТОЗОЛЬНЫХ БЕЛКОВ В ПЛАСТИДЫ
Если белок должен остаться в строме, то довольно сложный комплекс шаперонов, составленный из больших (Hsp60, мол. масса 60 кДа) и малых (10 кДа) субъединиц, обеспечивает его сворачивание в АТФ-зависимом процессе. Наоборот, белки, которые предназначены для люмена тилакоидов либо их мембран, поддерживаются шаперонами в развернутой форме, что необходимо для их дальнейшего транспорта. Белки, направляемые к внешней мембране, не транспортируются в строму, а попадают в мембрану непосредственно из цитозоля.
Белки, предназначенные для тилакоидов, содержат два сигнальных пептида («стромальный» и «люменальный), расположенных последовательно один за другим. Первый пептид направляет белок в строму хлоропласта. В строме протеаза удаляет «стромальный» пептид, что «открывает» второй лидерный пептид, который обеспечивает дальнейший транспорт белка через мембрану тилакоида. В люмене тилакоида второй сигнальный пептид отщепляется протеазой, и белок либо остается в люмене, либо встраивается в мембрану тилакоида.
БИОГЕНЕЗ ХЛОРОПЛАСТОВ
Основные этапы образования хлоропластов. Предшественники хлоропластов — пропластиды. Они образуются из инициальных частиц с зачатков, содержащихся в меристематических клетках. Их образование связано с разрастанием внутренней мембраны оболочки и образованием из нее нескольких складок, направленных внутрь. Формирование хлоропласта может осуществляться двумя путями: непосредственно из пропластид и опосредованно, через образование этиопластов.
Первый путь биогенеза хлоропластов — непосредственное преобразование пропластид в хлоропласты — реализуется при росте растений в условиях нормального соотношения дня и ночи. Пропластиды меристематических клеток листа превращаются в хлоропласты параллельно с ростом и дифференцировкой клеток листа. Биогенез хлоропластов сопровождается формированием тилакоидных мембран хлоропластов при участии внутренней мембраны оболочки пропластиды.
Второй путь — образование хлоропластов из этиопластов. Этиопласты — органеллы клеток растения, растущего в отсутствие света (этиолированного растения). Они образуются из пропластид и имеют некоторые особенности внутреннего строения: содержат проламелярное тело, сформированное в результате скопления ограниченных мембраной пузырьков и разветвленных трубчатых структур. Мембраны проламелярного тела содержат небольшие количества каротиноидов и предшественника хлорофилла — протохлорофиллида. Формирование тилакоидных мембран хлоропластов в этиопластах происходит при участии мембран проламелярного тела в ответ на освещение.
Таким образом, формирование хлоропласта происходит только на свету.
Выделяют три этапа фотоморфогенеза хлоропластов из этиопластов.
На первом этапе из трубчатых элементов проламелярных тел образуются крупные пузырьки, располагающиеся по радиусу. Этот процесс сопровождается образованием хлорофилла из имеющегося в этиопластах протохлорофиллида.
На втором этапе происходит накопление белков, липидов, пигментов и самосборка мембран тилакоидов. Свет активирует синтез белков внутренних мембран хлоропластов и фотосинтетических пигментов. Самосборка мембран идет на основе белковых компонетов, синтезируемых как в хлоропластах, так и в цитозоле, при скоординированной работе их белоксинтезирующих систем и транспорте белковых компонентов из цитоплазмы в хлоропласт. В основе самосборки мембран лежат физико-химические процессы (гидрофобные и электростатические взаимодействия), а также «молекулярное узнавание», обусловленное конформационными взаимодействиями.
На третьем этапе происходит формирование гран. Эта стадия совпадает с интенсивным синтезом хлорофилла. Для формирования гран необходим высокий уровень содержания хлорофиллов в хлоропластах, при этом особенно важна концентрация хлорофилла b. Хлорофилл b входит главным образом в состав CCKII — антенного комплекса ФСП. Сборка ССК2 в мембранах определяет возможность образования гран в хлоропластах.
Белки CCKII, связывающие хлорофилл Ь, кодируются генами ядра, их экспрессия регулируется светом.
Фоторегуляция связана с активацией светом синтеза пигментов и белков, входящих в светособирающие комплексы. Контроль синтеза фотосинтетических пигментов (хлорофиллов и каротиноидов) основан на регуляции светом активности осуществляющих его ферментов. Фоторегуляция синтеза белков хлоропластов осуществляется на генетическом уровне. В регуляции биогенеза хлоропластов участвуют сигнальные фоторецепторные системы — фитохромная система и рецепторы синего света.
Гормональная регуляция связана с влиянием на синтез пигментов и белков хлоропластов ряда фитогормонов. Так, цитокинины, активируя синтез хлорофиллов, способствуют формированию структуры хлоропласта. Этилен, напротив, ингибирует развитие листьев и дифференцировку хлоропластов в этиолированных проростках .
Генетическая регуляция включает реализацию генетической информации, включая транскрипцию, трансляцию, процессинг, транспорт белков, сборку мультипептидных комплексов. Обнаружена регуляция экспрессии ряда генов ядерной ДНК, обслуживающих хлоропласт светом, гормонами, продуктами фотосинтеза.
ПИГМЕНТНЫЕ СИСТЕМЫ
Хлорофиллы
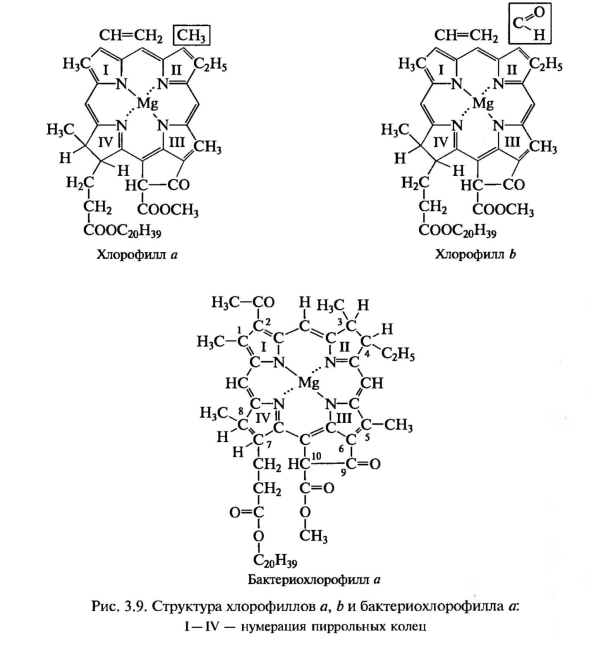
Известно 10 различных структурных форм хлорофиллов (хлорофиллы а, b, с, d, е, бактериохлорофиллы а, Ь, с, d и протохлорофилл), несколько форм фикобилинов, более 100 различных модификаций каротиноидов. Кроме того, одна и та же химическая структура в живом листе в комплексе с белками и липидами образует целую серию так называемых «нативных» форм. Так, для хлорофилла а известно около 10 таких спектрально различных форм. В итоге формируется мощная фоторецепторная система с большим набором различных спектральных форм.
Рассмотрим важнейшие из них. Хлорофилл а — универсальный пигмент высших растений и водорослей. У некоторых водорослей (синезеленых, некоторых красных) он представляет единственную форму хлорофилла. Максимум поглощения в органических растворителях в красной области спектра находится при длинах волн 660 — 664 нм.
Хлорофилл в — дополнительный пигмент высших растений и водорослей, впервые появляется у эвгленовых водорослей, заменяя фикобилины. Отличается от хлорофилла а наличием альдегидной группы вместо метальной —СН3 во II пиррольном кольце. Красный максимум поглощения в ацетоне 645 нм.
Хлорофилл с — дополнительный пигмент бурых и диатомовых водорослей. Он содержит магний, не этерифицирован фитолом, связь 7=8 не гидрирована, остаток пропионовой кислоты при С7 имеет двойную связь: —СН=СН—СООН.
Хлорофилл d — дополнительный пигмент красных водорослей, отличается от хлорофилла а наличием альдегидной группы при С2 вместо —СН=СН2. Красный максимум поглощения в органических растворителях 686 нм.
Бактериохлорофилл а — главный пигмент у фотосинтезирующих бактерий. Красный максимум поглощения — 770—780 нм. Центральный атом магния определяет важнейшие физические и химические свойства молекулы магнийпорфирина. Включение магния в тетрапиррольную структуру значительно изменяет спектральные свойства хлорофилла.
Магний и кетоэфирная группа в молекуле хлорофилла являются главными компонентами для формирования димерных структур пигментов реакционного центра.
Фитол представляет собой полиизопреноидную цепь, состоящую из 20 углеродных атомов (спирт фитол — С2оН39ОН), и является гидрофобным радикалом молекулы хлорофилла. Фитольная цепь не находится в электронном сопряжении с макроциклом и поэтому практически не влияет на электронную структуру хлорофилла в возбужденных состояниях S1 и S2. В нативной системе взаимодействие фитола с гидрофобными белками позволяет регулировать положение макроцикла по отношению к свету и, таким образом, изменять активность светопоглощения молекулой хлорофилла.
|
Поглощение фотона (hv) обусловлено переходом системы в различные энергетические состояния. В молекуле в отличие от атома возможны электронные, колебательные и вращательные движения, и общая энергия молекулы равна сумме этих видов энергий. Основной показатель энергии поглощающей системы — уровень ее электронной энергии, определяется энергией внешних электронов на орбите. Согласно принципу Паули, на внешней орбите находятся два электрона с противоположно направленными спинами, в результате чего образуется устойчивая система спаренных электронов. Поглощение энергии света сопровождается переходом одного из электронов на более высокую орбиту с запасанием поглощенной энергии в виде энергии электронного возбуждения. Важнейшая характеристика поглощающих систем — избирательность поглощения, определяемая электронной конфигурацией молекулы. В сложной органической молекуле есть определенный набор свободных орбит, на которые возможен переход электрона при поглощении квантов света. Согласно «правилу частот» Бора, частота поглощаемого или испускаемого излучения должна строго соответствовать разности энергий между уровнями.
Каждый электронный переход соответствует определенной полосе поглощения. Таким образом, электронная структура молекулы определяет характер электронно-колебательных спектров.
Запасание поглощенной энергии связано с возникновением электронновозбужденных состояний пигментов. Известно два основных типа возбужденных состояний — синглетные и триплетные. Они отличаются по энергии и состоянию спина электрона. В синглетном возбужденном состоянии спины электронов на основном и возбужденном уровнях остаются антипараллельными, при переходе в триплетное состояние происходит поворот спина возбужденного электрона с образованием бирадикальной системы. При поглощении фотона молекула хлорофилла переходит из основного (SQ) в одно из возбужденных синглетных состояний — S{ или S2, что сопровождается переходом электрона на возбужденный уровень с более высокой энергией. Возбужденное состояние S2 очень нестабильно. Электрон быстро (в течение 10-12 с) теряет часть энергии в виде тепла и опускается на нижний колебательный уровень где может находиться в течение 10-9 с. В состоянии S1 может произойти обращение спина электрона и переход в триплетное состояние Т1 энергия которого ниже S1. Возможно несколько путей дезактивации возбужденных состояний: — превращение энергии возбуждения в тепло;
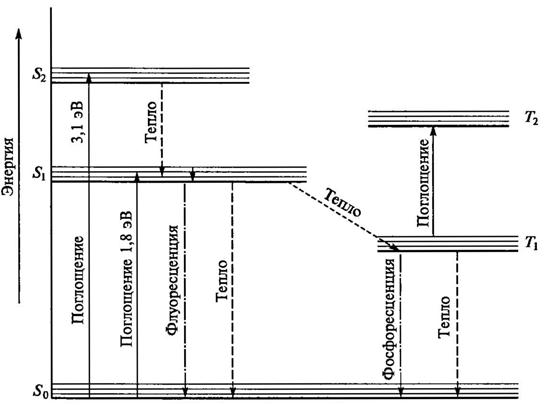 Рис. 3.7. Схема электронных переходов для магнийпорфиринов в полярном
растворителе:
Рис. 3.7. Схема электронных переходов для магнийпорфиринов в полярном
растворителе:
|
| S0 — основное состояние; Slt S2 — первое и второе синглетные возбужденные состояния; Ти Т2 — первое и второе триплетные возбужденные состояния |
— излучение фотона с переходом системы в основное состояние (флуоресценция или фосфоресценция);
— перенос энергии на другую молекулу;
— использование энергии возбуждения в фотохимической реакции.
Миграция энергии между молекулами пигментов может осуществляться по следующим механизмам. Индуктивно-резонансный механизм (механизм Фёрстера) возможен при условии, когда переход электрона оптически разрешен и обмен энергией осуществляется по экситонному механизму. Перенос энергии от возбужденной молекулы пигмента к другой молекуле осуществляется путем безызлучательного переноса энергии возбуждения. Электрон в возбужденном состоянии представляет собой осциллирующий диполь. Образующееся при этом переменное электрическое поле может вызвать аналогичные колебания электрона в другой молекуле пигмента при выполнении условий индукции, определяющих достаточно сильное взаимодействие между молекулами (расстояние не более 10 нм).
ФИКОБИЛИНЫ
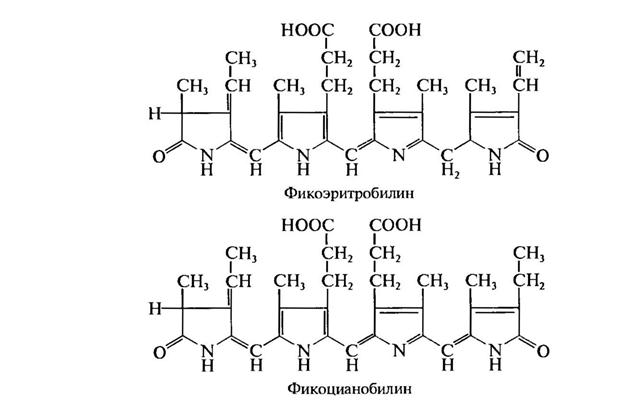
Фикобилины фикоцианин, фикоэритрин и аллофикоцианин входят в состав пигментных систем цианобактерий и красных водорослей, где вместе с хлорофиллом а выполняют функции фоторецепторов в фотосинтезе. Фикобилины представляют группу тетрапиррольных пигментов с открытой цепью. Они не содержат металла, отдельные пиррольные кольца соединены метиновыми (—СН=) и метиленовыми (—СН2—) мостиками и включают различные радикалы в форме метильных (—СН3), винильных (—СН=СН2), этильных (—СН2—СН3) групп, а также два остатка пропионовой кислоты (-СН2-СН2-СООН).
Фикоцианин (синего цвета) представляет собой комплекс фикоцианобилина (простетическая группа пигмента) с белком и является, таким образом, фикобилипротеидом с молекулярной массой 273 кДа.
Фикоэритрии (красного цвета) — комплекс фикоэритробилина с белком (молекулярная масса 226 кДа).
Аллофикоцыаиин — синий пигмент с молекулярной массой 134 кДа, состоящий из трех субъединиц.
Простетическая группа пигментов при участии двух свободных карбоксильных групп образует прочную ковалентную связь с белком, разрываемую только при нагревании с НС1. Пигментные комплексы водорастворимы и могут быть извлечены из клеток водорослей горячей водой.
Хромофорной группой фикобилинов является система сопряженных связей, которая образуется при участии атомов углерода и азота пиррольных колец и —СН-мостиков. В клетках водорослей фикобилины находятся в специальных гранулах — фикобилисомах, расположенных на поверхности мембран (рис. 3.16). Пигменты в грануле образуют последовательный ряд функционально связанных пигментных комплексов. На поверхности фикобилисомы расположены коротковолновые пигменты (фикоэритрин, 570 нм), ближе к мембране — пигменты с более длинноволновым максимумом (фикоцианин, 630 нм; аллофикоцианин, 650 нм ). Такое расположение пигментов в фикобилисоме позволяет с высокой скоростью и эффективностью осуществлять процессы миграции энергии, поглощаемой фикобилинами, на хлорофилл а, локализованный в мембране.
90 % энергии, поглощенной фикобилинами, мигрирует на хлорофилл а и используется в фотохимических реакциях. Для понимания физиологической роли данной группы пигментов большое значение имеет явление хроматической адаптации, исследованное в работах Н.М.Гайдукова, А.А.Рихтера, Т.Энгельмана и др. Было установлено, что содержание и состояние пигментов у водорослей зависят от условий освещения. При изменении спектрального состава света изменяется пигментный состав, увеличивается количество пигментов, поглощающих дополнительный по отношению к падающему свет. Процесс хроматической
 Структурные формулы фикобилинов
Структурные формулы фикобилинов
|
Фикобилины функционируют как дополнительные пигменты в составе фотосистемы II
0,7
|
адаптации позволяет водорослям оптимально использовать световую энергию, проникающую через толщу воды. В процессе эволюции, начиная с эвгленовых водорослей, фикобилины как дополнительные пигменты были заменены на хлорофилл Ь, циклическая структура которого более устойчива по сравнению с открытой цепью фикобилинов, и дальнейший путь эволюции фотоавтотрофных организмов происходил на основе циклических тетрапирролов —хлорофиллов .
КАРОТИНОИДЫ
Каротиноиды — большая и разнообразная группа желтых, оранжевых, красных пигментов, поглощающих коротковолновую часть видимой области спектра (400—550 нм) и выполняющих ряд очень важных функции в фотосинтезе.
По химической природе каротиноиды представляют собой полиизопреноидную цепь, состоящую из 40 атомов углерода, которая у большинства каротиноидов замыкается по концам в два иононовых кольца. Центральная часть молекулы, состоящая из 18 атомов углерода, представляет собой систему сопряженных связей, образуя основную хромофорную группу молекулы пигмента.
В зависимости от содержания кислорода в молекуле каротиноида различают каротины (например, β-каротин), не содержащие кислорода, и ксантофиллы — содержащие кислород в форме гидрокси-группы —ОН или эпокси-группы
У высших растений главными представителями ксантофиллов являются лютеин, виолаксантин, зеаксантин и неоксантин.Каротиноиды присутствуют в мембранах у всех фотосинтезирующих организмов, где они выполняют ряд важнейших функций в процессе фотосинтеза — антенную (дополнительные пигменты в процессе поглощения солнечной энергии), защитную (тушители триплетного хлорофилла и синглетного кислорода) и фотопротекторную (предохраняют реакционный центр от мощных потоков энергии при высоких интенсивностях света и стабилизируют липидную фазу тилакоидных мембран, защищая ее от переокисления.
Антенная функция каротиноидов
Антенная функция предполагает энергетическое взаимодействие каротиноидов и хлорофиллов. Антенная функция имеет место в ССК. Возможность миграции энергии в пигмент-белковом комплексе от возбужденных каротиноидов к хлорофиллу доказана экспериментально. Таким образом, главная функция каротиноидов в ССК — поглощение энергии и перенос ее на хлорофилл.
Каротиноиды характеризуются спектром поглощения в синезеленой области (400—550 нм). Хромофорная группа различных каротиноидов может включать от 9 до 13 двойных связей, что определяет положение максимумов, энергию возбуждения и общий вид спектра поглощения. У большинства каротиноидов спектр поглощения имеет главный максимум и два более или менее выраженных «плеча».
Защитная функция каротиноидов
Каротиноиды в антенном комплексе и реакционном центре выполняют уникальную «защитную» функцию, и связана с тушением возбужденных триплетных состояний хлорофилла и синглетного кислорода (102). Механизм фотоповреждения фотосинтетического аппарата в случае оксигенного фотосинтеза обусловлен фотодеструктивным действием активных форм кислорода, главным образом синглетного кислорода 102, образующегося при взаимодействии основной формы кислорода в атмосфере 02 с триплетно-возбужденным пигментом хлорофиллом. Образующийся синглетный кислород является сильным окислителем и вызывает фотоокисление окружающих структур. Особенно активно эти процессы протекают в реакционных центрах, где образование триплетного хлорофилла (3Хл) происходит в результате возможного возврата богатого энергией электрона от первичного акцептора к пигментам реакционного центра или П700 Каротиноиды, содержащие 9 и более двойных связей, могут эффективно тушить триплетное состояние хлорофилла и образовавшийся синглетный кислород. Механизм защитного действия p-каротина в реакционном центре включает перенос энергии от 3Хл или '02 к β-каротину и диссипацию энергии образующегося триплетного каротина через релаксацию в тепло с переходом p-каротина в состояние S0.
Фотопротекторная функция каротиноидов
Фотопротекторная функция каротиноидов состоит в защите фотосинтетического аппарата от излишка энергии возбуждения при высокой интенсивности света. Эта функция связана с каротиноидами, образующими так называемый «ксантофилловый цикл». У высших растений и зеленых водорослей ксантофилловый цикл включает энзиматическое превращение виолаксантина в зеаксантин. Процесс катализируется ферментом деэпоксидазой, требует участия аскорбата и кислой среды (оптимум действия фермента при рН 5,0). Такие условия рН создаются в люмене при освещении хлоропластов. В темноте протекает обратная реакция превращения зеаксантина в виолаксантин, которая катализируется эпоксидазой.
ОРГАНИЗАЦИЯ ПИГМЕНТОВ
В ХЛОРОПЛАСТАХ
| <== предыдущая страница | | | следующая страница ==> |
| Транскрипция пластидных генов обеспечивается двумя типами РНК-полимераз, одна из которых кодируется в ядре растительной клетки, тогда как другая — пластидной ДНК | | | Светособирающие комплексы |
Дата добавления: 2014-02-28; просмотров: 1365; Нарушение авторских прав

Мы поможем в написании ваших работ!