
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Эффэкт Эммерсона
Впервые идею о существовании в хлоропластах двух фотосистем высказал Р. Эмерсон (1957), изучая влияние света на квантовый выход фотосинтеза у хлореллы.
МЕХАНИЗМ ПРЕОБРАЗОВАНИЯ ЭНЕРГИИ В РЕАКЦИОННЫХ ЦЕНТРАХ
Особенности организации реакционных центров. Димерная структура пигмента реакционного центра. Две молекулы хлорофилла а расположены на двух субъединицах; А и В — в фотосистеме I; D1 и D2 — в фотосистеме II. Димерная структура пигмента обеспечивает сдвиг максимума поглощения в длинноволновую область, что позволяет пигменту реакционного центра служить эффективной ловушкой энергии возбуждения других пигментов, используя их в качестве светосборщиков. При образовании димеров в два раза увеличивается площадь поперечного сечения пигмента, что обеспечивает эффективный захват фотона. В связи с образованием у димера более длинноволнового максимума поглощения снижается константа скорости флуоресценции, которая обратно пропорциональна длине волны излучения. Поскольку флуоресценция — конкурирующий процесс, димерная структура ограничивает бесполезную дезактивацию возбужденного состояния и потерю энергии в виде флуоресценции.
Первичный акцептор во всех реакционных центрах — тетрапиррол. Это увеличивает константу скорости переноса электрона, которая зависит от перекрывания орбиталей П и А, т.е. донора и акцептора электронов. Многокомпонентный акцепторный комплекс в реакционных центрах растений позволяет эффективно осуществлять трансмембранное разделение зарядов. Таким образом, особенности структурной организации реакционных центров создают высокую квантовую эффективность первичных процессов и высокую скорость реакций переноса электронов. За счет близкого расположения П и А и сходства их химической структуры константа скорости переноса электрона в реакционных центрах достигает 5 • Ю~10 с.
Фотохимический механизм преобразования энергии. Все реакционные центры имеют не только общий принцип организации, но и единый фотохимический механизм преобразования энергии. В реакционном центре происходит первичное фотохимическое разделение зарядов между фотовозбужденным пигментом реакционного центра и первичным акцептором. Поскольку П взаимодействует с А в реакциях окислительно-восстановительного типа, структура, осуществляющая преобразование энергии, должна быть способна к обратимым окислительно-восстановительным реакциям. Как известно, молекула хлорофилла способна к фотовосстановлению и фотоокислению. Исследования с применением лазеров и высокоскоростной импульсной спектрофотометрии показали, что в реакционном центре реализуется фотоокислительный путь. Реакция фотоокисления хлорофилла требует особых условий: присутствия ионов магния в центре молекулы и слабокислых условий среды (В.Б.Евстигнеев, 1967). Именно такие условия создаются в нем при освещении и векторном движении протонов во внутритилакоидное пространство.
В основе преобразования энергии лежит процесс разделения зарядов. Первичный этап включает две сопряженных окислительно-восстановительных реакции:
hv
1) Хл —^ Хл+ + е (для реакции необходима затрата энергии, равная энергии ионизации хлорофилла);
2) А + ё —А~ (освобождается энергия, равная энергии ионизации акцептора А).
Энергия, запасаемая в процессе разделения зарядов, равна разности энергий ионизации акцептора и хлорофилла: ДЕ = ЕА - Е^. Следовательно, чем меньше энергия ионизации хлорофилла, тем больше величина запасаемой энергии ДЕ.
Разделение зарядов в реакционном центре включает три стадии.
Первая стадия — первичное разделение зарядов. Высоко разрешающая техника в фемтосекундном интервале (10~15 с) позволила выделить два процесса на начальной стадии преобразования энергии — перенос энергии и перенос электронов в реакционном центре: перенос энергии происходит быстрее, чем перенос электрона.
Вторая стадия — фотоокисление пигмента П680. Разделение зарядов между возбужденным П680 и первичным акцептором электрона Фео осуществляется в течение нескольких пикосекунд. В результате образуется первичная радикальная пара (П680-Фео~). В течение следующих 200 пс происходит перенос электрона от Фео" на Qa с образованием вторичной радикальной пары (Пб80-Фео) — восстановленного Qa и окисленного П680
Третья стадия — восстановление пигмента. Окисленный пигмент П680 имеет высокий окислительно-восстановительный потенциал (+1,12 В) и является очень активным окислителем, который может вызвать окислительную деструкцию окружающих структур. Донором электрона для П680 нормальных физиологических условиях является тирозин Z, для которого источником электрона служит сложная система фотоокисления воды. В фотоокислении воды в восстановлении П680 участвует тирозин D, цитохром в559, Хл2, β-каротин.
.Компоненты ЭТЦ хлоропластов, их природа и физико-химические свойства
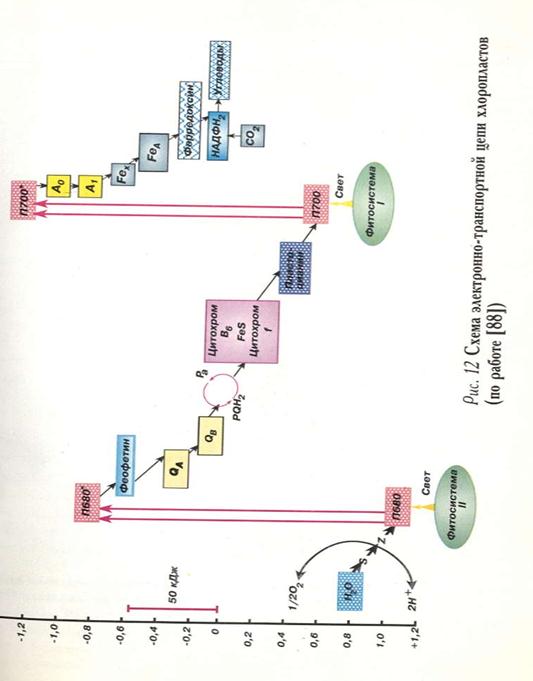
Электрон-транспортная цепь — это цепь редокс-агентов, определенным образом расположенных в мембране хлоропластов, осуществляющих фотоин- дуцируемый транспорт электронов от воды к НАДФ+. Движущей силой транспорта электронов по ЭТЦ фотосинтеза являются окислительно-восстановительные реакции в реакционных центрах (РЦ) двух фотосистем (ФС). Первичное разделение зарядов в РЦ ФС1 приводит к образованию сильного восстановителя А~, окислительно-восстановительный потенциал которого обеспечивает восстановление НАДФ+ через цепь промежуточных переносчиков. В РЦ ФС2 фотохимические реакции ведут к образованию сильного окислителя П680, который вызывает ряд окислительно-восстановительных реакций, приводящих к окислению воды и выделению кислорода. Восстановление П700, образованного в РЦ ФС1, происходит за счет электронов, мобилизованных из воды фотосистемой II, при участии промежуточных переносчиков электронов (пластохинонов, редокс-кофакторов цитохромного комплекса и пластоцианина). В отличие от первичных фотоиндуцированных реакций разделения зарядов в реакционных центрах, идущих против термодинамического градиента, перенос электрона на других участках ЭТЦ идет по градиенту окислительно-восстановительного потенциала и сопровождается высвобождением энергии, которая используется на синтез АТФ.
ЭТЦ хлоропластов включает ряд переносчиков, общих для всех типов редокс-цепей живых организмов. К ним относятся цитохромы, железосерные белки, хиноны, флавиновые ферменты и пиридиннуклеотиды. Вместе с тем в ЭТЦ хлоропластов входят специфические переносчики электронов, такие как циклические тетрапирролы (хлорофиллы реакционных центров, феофитин), марганецсодержащий кластер, осуществляющий окисление воды, некоторые аминокислотные остатки белков (тирозин в ФСИ) и медьсодержащий белок пластоцианин.
Редокс-агенты ЭТЦ хлоропластов включены в состав трех интегральных мультипептидных комплексов, расположенных в мембранах тилакоидов, — ФС1, ФС2 и цитохромный 66/f-комплекс. Кроме того, некоторые компоненты ЭТЦ свободно перемещаются по поверхности мембраны (пластоцианин, ферредоксин) или в ее толще мембраны (пластохиноны) и осуществляют связь между функциональными комплексами. Ниже дана краткая характеристика редокс-компонентов ЭТЦ хлоропластов.
Цитохромы в ЭТЦ хлоропластов представлены двумя цитохромами группы Ъ {цитохром Ь559 и цитохром й563, или цитохром 66) и цитохромом f Каждый из двух цитохромов группы Ъ найден в хлоропластах в виде двух редокс-форм — низкопотенциальной (L) и высокопотенциальной (Н). Железосерные белки. В ЭТЦ хлоропластов входят 3 железосерных центра, содержащих [4Fe-4S]-кластеры Fх, Fа и FB, и 2 белка с [2Fe-2S] — ферредоксин (ФД) и центр Риске. Железосерные кластеры Fх, Fа и FB и ферредоксин отличаются низкими окислительно-восстановительными потенциалами (от -0,7 В до -0,42 В). Они участвуют в восстановлении НАДФ+ в ФС1. Центр Риске имеет необычно высокий для железосерных белков окислительно-восстановительный потенциал (около +0,3 В). Он находится в цитохромном в6/-комплексе и осуществляет окисление пластохинолов.
Хиноны. Представители двух групп хинонов — пластохиноны и филлохинон включены в ЭТЦ фотосинтеза. Филлохинон (витамин К) — переносчик электронов на акцепторной стороне ФС1 (А1, участвует в переносе электронов от первичного акцептора электронов. Имеет очень низкий окислительно-восстановительный потенциал (около -0,8 В). Пластохиноны (PQ) осуществляют транспорт электронов на акцепторной стороне ФС2 (QA и QB), а также между комплексом ФСИ и цитохромysv комплексом в составе пула пластохинонов. Окислительно-восстановительный потенциал пластохинонов близок к нулю.
Фермент ферредоксин-НАДФ-оксидоредуктаза (ФНР) содержит в качестве редокс-кофактора ФАД. Восстанавливает НАДФ+ в ФС1. Электроны для восстановления получает от восстановленного ферредоксина (ФД). Окислительно-восстановительный потенциал равен -0,36 В.
Пластоцианин (Пц) — водорастворимый белок, содержащий 1 атом меди. Осуществляет перенос электронов по одноэлектронному типу, причем атом меди изменяет свою валентность (Си+ Си 2+). Окислительно-восстановительный потенциал Пц равен +0,37 В. Пц восстанавливает окисленный пигмент РЦ ФС1 П700 и окисляет цитохром b6 цитохромного комплекса хлоропластов.
Марганецсодержащий кластер (Мп-кластер). Располагается в комплексе ФС2 и образует систему окисления воды (S). Кластер включает 4 атома марганца, валентность которых меняется в ходе индуцируемых светом окислительно-восстановительных реакций. Окислительно-восстановительный потенциал максимально окисленного кластера около +0,9 В. Мп-кластер окисляет воду с образованием молекулярного кислорода.
Электроны от Mn-кластера передаются на Пб80 через промежуточный переносчик электронов (Tyrz) — остаток тирозина (Туг-161) белка D1 ФС2. Окислительно восстановительные реакции идут с образованием нейтрального радикала тирозина.
Тетрапиррольные переносчики электронов — уникальные компоненты ЭТЦ хлоропластов. Они являются первичными донорами и первичными акцепторами электронов в реакционных центрах ФС1 и ФСИ. Окислительно-восстановительные реакции циклических тетрапирролов сопровождаются образованием заряженных радикалов.
Z-схема фотосинтеза. Нециклический, циклический, псевдоциклический транспорт электронов в хлоропластах
Последовательность расположения редокс-агентов в ЭТЦ хлоропластов в соответствии с их окислительно-восстановительным потенциалом и данными по их локализации в комплексах отражает Z-схема фотосинтеза. Согласно Z-схеме, существует последовательный перенос электронов от ФСИ к ФС1 и две фотосистемы объединяются в единую цепь переноса электронов от воды к НАДФ+. Представление о существовании в хлоропластах двух фотосистем и их совместной последовательной работе впервые возникло в 1940-е гг. на основании опытов лаборатории Р. Эмерсона, обнаруживших эффект красного падения квантового выхода фотосинтеза при освещении хлоропластов монохроматическим дальним красным светом 680 -700 нм, возбуждающим только ФС1, и эффект усиления квантового выхода фотосинтеза при добавлении к дальнему красному свету подсветки с длиной волны около 650 нм (возбуждающей ФСК). Позднее было показано, что в хлоропластах транспорт электронов возможен не только от воды к НАДФ+ с участием двух фотосистем, но и другие альтернативные пути с участием лишь одной из двух фотосистем. Кроме того, конечным акцептором электронов в ЭТЦ фотосинтеза вместо НАДФ+ может выступать молекулярный кислород. В настоящее время различают нециклический, циклический и псевдоциклический транспорт электронов в хлоропластах.
Нециклический транспорт электронов — это перенос электронов от воды к НАДФ+, осуществляемый с участием двух фотосистем, цитохромного комплекса и промежуточных низкомолекулярных переносчиков — пула пластохинонов (PQ), пластоцианина (Пц), ферредоксина (ФД) и ферредоксин-НАДФоксидоредуктазы (ФНР). Он сопровождается выделением кислорода и восстановлением НАДФ+. Сопряжен с синтезом АТФ (нециклическое фотофосфорилирование).
Циклический поток электронов осуществляют отдельно ФС1 или ФС2.
Циклический транспорт с участием ФС1
включает перенос электронов от восстановленного ферредоксина (ФД) обратно к окисленному П7оо- При этом участвует пул пластохинонов, цитохромный комплекс и особый фермент ФД-хиноноксидоредуктаза (FQR). Циклический
поток электронов с участием ФС1 сопряжен с синтезом АТФ (циклическое фотофосфорилирование) и может обеспечивать дополнительный синтез АТФ, необходимый для процессов ассимиляции углерода. Он может быть альтернативным путем использования энергии.
Циклический поток электронов в ФС2 связан с обратным переносом электронов от восстановленных первичных хинонов QA и (или) QB к окисленному пигменту реакционного центра Пб80. При этом
участвуют цитохром Ь559, β-каротин и сопровождающие молекулы хлорофиллаaреакционного центра ФС2.Циклический поток электронов в ФС2 является альтернативным путем использования энергии света. Он активируется в условиях, когда интенсивность света превышает возможности ЭТЦ утилизировать его энергию или при повреждении водоокисляюшей системы хлоропластов.
Псевдоциклический поток электронов — перенос электронов от воды на кислород — впервые был исследован А. Мелером (Mehler, 1951) и назван его именем —реакция Мелера.
Восстановление кислорода может происходить как в ФС1, так и в ФС2. При этом поглощение кислорода может компенсировать его выделение в ходе фотоокисления Н20. В результате единственным продуктом этого процесса, как и в случае циклического потока электронов, будет АТФ, синтезируемая при псевдоциклическом фотофосфорилировании.
Псевдоциклический поток электронов приводит к образованию активных форм кислорода (супероксиданионрадикала O2-, перекиси водорода Н202), поэтому активация процесса может вызвать нарушения фотосинтетического аппарата. Этот альтернативный транспорт электронов активируется при высоких интенсивностях света в условиях дефицита в хлоропластах окисленного НАДФ+.
ФОТОФОСФОРИЛИРОВАНИЕ
Результатом переноса электронов по ЭТЦ является процесс трансформации энергии окисления гидрохинонов (QH2) в электрическую энергию — электрохимический градиент ионов Н+ на мембране тилакоида. Протонный градиент дополняется работой ФС2 по фотоокислению воды. Два протона при окислении молекулы воды освобождаются в полость тиллакоидов. При синтезе НАДФН один протон поглощается из стромы, увеличивая разность концентраций протонов на мембране. Дальнейшие энергетические превращения на мембране тилакоида уже осуществляются АТР-синтазным комплексом, в котором происходит трансформация градиента ионов Н+ в энергию макроэргической связи АТР.
АТФ- синтетазный комплекс Хлоропластный АТФ-синтазный комплекс принадлежит семейству АТФаз F1-типа, которые характерны также для бактерий и митохондрий. Комплекс продуцирует АТФ из АДФ и неорганического фосфата. Для этого используется энергия трапсмембраниого протонного градиента, генерируемого при движении электронов по цепи электронного транспорта за счет фотохимической трансформации световой энергии.
АТФ-синтазный комплекс состоит из двух частей: погруженного в мембрану протонного канала CF0 и энзиматического центра CF1, выступающего над поверхностью мембраны в сторону стромы. На последнем расположены места связывания АДФ и Фн. CF1 состоит из 5 субъединиц, α. β, у, ∆, ﻍ , которые являются поверхностными белками и прикрепляются к мембране со стороны стромы. Их стехиометрия 3:3:1:1:1. C.F0 включает 4 субъединицы, suI-IV, в предполагаемой стехиометрии 1:1:9:1.
Представления о структурной организации субъединиц АТФ- синтазного комплекса в мембране были сформированы благодаря недавним успехам в применении методов ядерного магнитного резонанса и ренгено-структурного анализа. Активный фермент CF представлен в мембране в виде ансамбля статических частей и подвижных, вращающихся, как для трансмембранных, так и поверхностных субъединиц. Статическая часть состоит из субъединиц I, II, IV CF0 и α. β, ∆ CF1. К подвижной части относятся субъединицы CF1 у и ﻍ, также 9 копий субъединицы III CF0.
Структура головки фермента установлена на основании данных, полученных при изучении бактериального и митохондриального комплексов. Головка представлена гексомерным кольцом из перемежающихся α и β –субъединиц. Таким образом, формируются три группы α. β, -гетеродимеров, которые могут принимать три нуклеотид-связывающие конформации: незаполненный, пустой сайт, АДФ/Р|неорг и АТФ прочно связывающие сайты. Эти структурные особенности обеспечивают реализацию вращательного механизма, согласно которому центральная у- субъединица осуществляет вращение в пределах α. β, гексамера, проводя фермент через три последовательные конфигурации, необходимые для синтеза/ гидролиза АТФ. Часть у-субъединицы выступает ниже С-терминального домена а- и р-субъединиц. Выступающая часть y-субъединицы взаимодействует с CF0 и дает вклад в ножку фермента, которая видна на электронных микрофотографиях, полученных при низком разрешении. Наиболее вероятно, что вклад CF0 в ножку обеспечивается экспонированными в строму С-терми- нальными доменами двух гомологичных субъединиц I и

|
. Модель организации в мембране АТФ-синтетазного комплекса
II, которые заякорены в мембране одной N-терминальной а-спиралью. 5-субъединицу тоже считают частью ножки.
Имеются экспериментальные доказательства участия субъединицы sil11 в связывание CF0 с CF1|. Структурная организация этих трансмембранных компонентов CF0 сектора ещё полностью не выяснена. Основываясь на данных по разрешенной структуре бактериального гомолога suIII, предполагают, что эти субъединицы расположены в виде кольца. Это кольцо, как предполагают, вращается вокруг субъединицы IV CF0, обеспечивая проводимость протонов.
| <== предыдущая страница | | | следующая страница ==> |
| Компоненты ЭТЦ хлоропластов, их природа и физико-химические свойства | | | Фотодыхание |
Дата добавления: 2014-02-28; просмотров: 895; Нарушение авторских прав

Мы поможем в написании ваших работ!