
Главная страница Случайная лекция

Мы поможем в написании ваших работ!
Порталы:
БиологияВойнаГеографияИнформатикаИскусствоИсторияКультураЛингвистикаМатематикаМедицинаОхрана трудаПолитикаПравоПсихологияРелигияТехникаФизикаФилософияЭкономика

Мы поможем в написании ваших работ!
Фотодыхание
Хемиосмотический механизм синтеза АТР. Механизм фосфорилирования ADP, сопряженный с работой электрон-транспортной цепи на сопрягающих мембранах, объясняет хемиосмотическая теория, разработанная в 1961-1966 гг. применительно к митохондриям английским биохимиком, Нобелевским лауреатом 1978 г. Питером Митчеллом. Он ввел понятие сопрягающей мембраны, т. е. мембраны, на которой процесс транспорта протонов сопряжен с процессом синтеза АТР. Такие мембраны, по его мнению, должны быть непроницаемы для протонов и иметь электрон-транспортную цепь, в которой переносчики электронов и протонов чередуются с переносчиками только электронов'. Сущность теории Митчелла можно свести к двум положениям: во-первых, электрон-транспортная цепь функционирует таким образом, что на мембране возникает электрохимический градиент ионов Н+, а во-вторых, обратный ток ионов Н+ через протонный канал сопровождается образованием энергии фосфатной связи АТР. Первоначально его теория обясняла механизм синтеза АТФ в митохондриях.
В 1967 г. Андреа Ягендорф использовал теорию Митчелла для объяснения процессов фотпофосфорилирования на тилакоидной мембране. Изолированные из хлоропластов граны с рН 8 помещали в буферный раствор с рН 4. После инкубации рН в гранах выравнивался до 4. Затем граны с рН 4 переносились в буферный раствор с рН 8. Таким образом на тилакоидных мембранах искусственно задавался градиент протонов, который обычно формируется при фотохимических процессах (внутри тилакоида —рН 4, а снаружи — рН 8). В этих условияхосле добавления в среду ADP и Рн в темноте синтезировалась АТР. Эти эксперименты являются хорошим подтверждением применимости хемиосмотической теории Митчелла для объяснения процессов, происходящих при фотофосфорилировании в хлоропластах.
Сам процесс синтеза АТФ обясняет обменно-связывающий механизм синтеза АТФБойера, который включает три принципиальных положения.
• Основным этапом, требующим энергии, является не синтез АТР из ADP и Рн, а процесс отделения АТР от фермента.
• В АТР-синтазном комплексе связывание субстратов и высвобождение продуктов реакции происходит в трех отдельных, но взаимодействующих между собой каталитических участках фермента. При этом каждый каталитический участок может существовать только в одном из трех конформационных состояний.
• Поток ионов Н+ через протонный канал Fo по градиенту электрохимического потенциала вызывает вращение Ў-субъединицы АТР-синтазного комплекса. Это вращение приводит к конформационным изменениям в каталитических участках, которые позволяют АТР высвобождаться от фермента и процессу идти дальше.
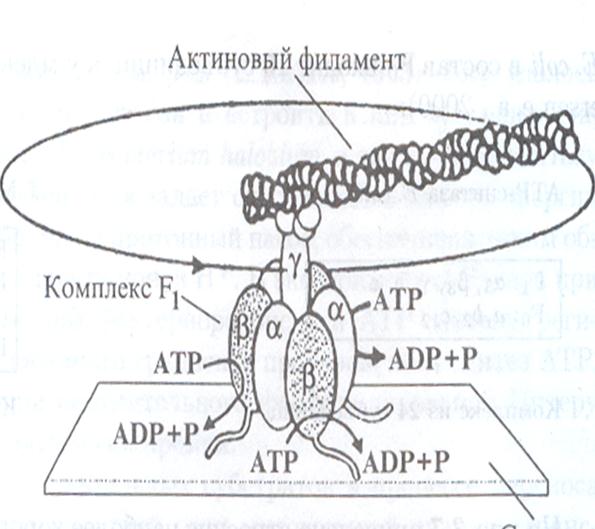
Опыт который позволил доказать вращение субъединицы в АТР- синтезирующем комплексе.
Два первых постулата Бойера получили много подтверждений, основанных главным образом на анализе кинетики процесса, и являются общепринятыми. Утверждение же о вращательном механизме процесса сопряжения между потоком Н+ и синтезом АТР доказать было сложнее. Это удалось сделать группе английских исследователей в лаборатории Джона Уокера в Кембридже. Они провели высоко разрешающий кристаллографический анализ структуры Fi-комплекса АТРазы митохондрий быка. Выло выявлено, что в каталитический комплекс входят три β- и три α-субъединицы, которые расположены, чередуясь подобно долькам апельсина . Три α/β гетеродимера отличаются друт от друга и конформационно, и по связанным с ними нуклеотидам, что подтверждает наличие механизма синтеза АТР по принципу связывание-обмен. При этом Ў -субъединица, как стержень, вставлена внутрь каталитического комплекса. Между а- и β -субъединицами обнаружены высокогидрофобные взаимодействия, что обеспечивает возможность вращения Ў -субъединицы внутри полости, образуемой в каталитическом центре фермента.
После анализа кристаллической структуры Fj-комплекса АТР-синтазы были сняты практически все вопросы, касающиеся механизма синтеза АТР. Однако окончательное доказательство вращения Ў -субъединицы в каталитическом центре фермента можно было бы получить, если бы его удалось зарегистрировать визуально. Такой эксперимент удалось провести Масасуке Ешида с коллегами в Токийском технологическом институте Японии. Они пометили флуоресцентным зондом актиновый филамент и «пришили» его к Ў -субъединице F1-комплекса. Затем комплекс F1 был прикреплен к специально обработанной стеклянной поверхности, по которой невозможно скольжение (рис.). Исследователи предположили, что если Ў -субъединица действительно способна вращаться под действием АТР, то будет вращаться и прикрепленный к ней актиновый филамент. Поскольку размеры фила мента составляли около 1 мкм, его вращение должно быть видно во флуоресцентный микроскоп.
Результаты эксперимента оказались потрясающими. Как только к модифицированному комплексу F1 была добавлена АТР, актиновые филаменты начинали вращаться по кругу со средней скоростью
4 оборота в секунду. Поскольку размеры актинового филамента значительно превышали размеры ферментативного комплекса, реальная скорость вращения Ў -субъединицы должна быть гораздо выше. Демонстрация вращательного движения Ў -субъединицы позволила окончательно решить вопрос омеханизме синтеза АТР в А'ГР-синтазном комплексе.Согласно современной модели функционирования АТР-синтазного комплекса хлоропластов источником энергии для мембранного транспорт протонов является градиент (протондвижущая сила) на мембране тиллакоидов. Движение ионов Н+ по протонному каналу АТР-синтазы вызывает вращение 111- субъединичного комплекса внутри мембраны. Это инициирует вращениеЎ -субъединицы, тесно связанной с Fo-комплексом. Вращение Ў -субъединицывнутри F1-комплекса вызывает конформационные изменения в каталитическом центре, необходимые для синтеза АТР. Предполагается, что каталитический комплекс сам по себе не вращается и крепится к мембране с помощью а-, Ь- и ∆-субъединиц. В терминах электротехники F1-комплекс и его мембранный «якорь» (субъединицы а и Ь) сравнивают со статором, в то время как Ў -субъединицу и вращающуюся часть Fo-комплекса — с ротором. За свой вклад в установление механизма синтеза АТР П.Бойер и Д. Уокер в 1997 г. получили Нобелевскую премию.
Путь углерода в фотосинтезе (темновоя фаза фотосинтеза)
В результате фотохимических реакций в хлоропластах создается необходимый уровень АТР и NADPH. Эти конечные продукты световой фазы фотосинтеза стоят на входе в темновую фазу, где С02восстанавливается до углевода.
Однако сами по себе АТР и NADPH не в состоянии восстановить С02. Очевидно, и темновая фаза фотосинтеза — сложный процесс, включающий большое количество реакций. Кроме того, существуют различные пути восстановления СО2,. В настоящее время известны так называемые С3-путь и С4-путь фиксации С02, фотосинтез по типу толстянковых (САМ-метаболизм) и фотодыхание. Рассмотрим каждый из этих путей в отдельности.
Этот способ ассимиляции С02, присущий всем растениям, в 1946—1956 гг. был расшифрован американским биохимиком М. Кальвином и его сотрудниками. Прежде всего была поставлена задача обнаружить первичный продукт фотосинтеза и выяснить, какое соединение служит акцептором С02.
Для решения первого вопроса были использованы одноклеточные зеленые водоросли (хлорелла и др.) и меченый
14С02. Фотосинтезирующие водоросли помешали в среду, содержащую 14С02, на разные промежутки времени, затем клетки быстро фиксировали, экстрагировали из них спирторастворимые вещества и определяли содержание 14С в различных соединениях после их разделения с помощью хроматографии. Оказалось, что после экспозиции в течение I мин 14С включался в С3—С7-сахара и фосфосахара, в органические кислоты (яблочную, щавелевоуксусную, ФЕП), в аминокислоты (аланин, аспарагиновую кислоту). Если же время экспозиции было сокращено до 0,1—2 с, то большая часть метки обнаруживалась в фосфоглицериновой кислоте, в ее карбоксильной группе.
Следовательно, 3-фосфоглицериновая кислота (ФГК) является первичным продуктом фотосинтеза.
Второй вопрос — природа первичного акцептора С02. Сначала предположили, что таким акцептором является какое-либо двухуглеродное соединение. Однако введение в инкубационную среду винилфосфата, фосфогликольальдегида и других веществ с С2не приводило к увеличению содержания радиоактивной метки из С02в ФГК. Тогда схему опыта видоизменили следующим образом. Водоросли экспонировали на свету при высокой (1 %-ной) концентрации С02, затем резко снижали его концентрацию до 0,003%. Расчет был на то, что в условиях дефицита С02быстро накопится именно то соединение, которое служит акцептором С02. С помощью двумерной хроматографии удалось установить, что при отсутствии возможности карбоксилирования в клетках кратковременно возрастает концентрация рибулозо-1,5-дифосфата (рибулозо-1,5-бисфосфата). Отсюда возникло предположение, что первичная фиксация С02происходит следующим образом: С5+ С02 ► С6—-» 2С3.
Эта реакция катализируется рибулозодифосфаткарбоксилазой (рибулозобисфосфаткарбоксилазой; другие названия — белок фракции I, карбоксидисмутаза). Максимум активности фермент имеет при рН 7,8-8,0 и нуждается в присутствии ионов Mg2 + .
Дальнейшая работа в лаборатории Кальвина и в других лабораториях привела к расшифровке всех последующих реакций С3-пути фотосинтеза, который получил название цикла Кальвина (рис. 3.13). Этот цикл, весьма напоминающий обращенный пентозофосфатный путь дыхания, состоит из трех этапов: карбоксилирования, восстановления и регенерации.
1) Карбоксилирование. Молекулы рибулозо-5-фосфата фосфорилируются с участием АТР и фосфорибулозокиназы, в результате чего образуются молекулы рибулозо- 1,5-дифосфата, к которым в свою очередь присоединяется С02 с помощью рибулозодифосфаткарбоксилазы. Полученный продукт расщепляется на две триозы: 2 молекулы 3-фосфо- глицериновой кислоты (3-ФГК).
2)Фаза восстановления. 3-ФГК восстанавливается до 3-фосфоглицеринового альдегида (3-ФГА) в два этапа. Сначала происходит фосфорилирование 3-ФГК при участии АТР и фосфоглицераткиназы до 1,3-дифосфоглицериновой кислоты, а затем восстановление 1,3-ФГК с помощью NADPH и дегидрогеназы фосфоглицеринового альдегида.
3)Фаза регенерации первичного акцептора диоксида углерода и синтеза конечного продукта фотосинтеза. В результате описанных выше реакций при фиксации трех молекул С<Э2 и образовании шести молекул восстановленных 3-фосфотриоз пять из них используются затем для регенерации рибулозо- 5-фосфата, а один — для синтеза глюкозы. 3-ФГА под действием триозофосфатизомеразы изомеризуется в фосфодиоксиацетон. При участии альдолазы 3-
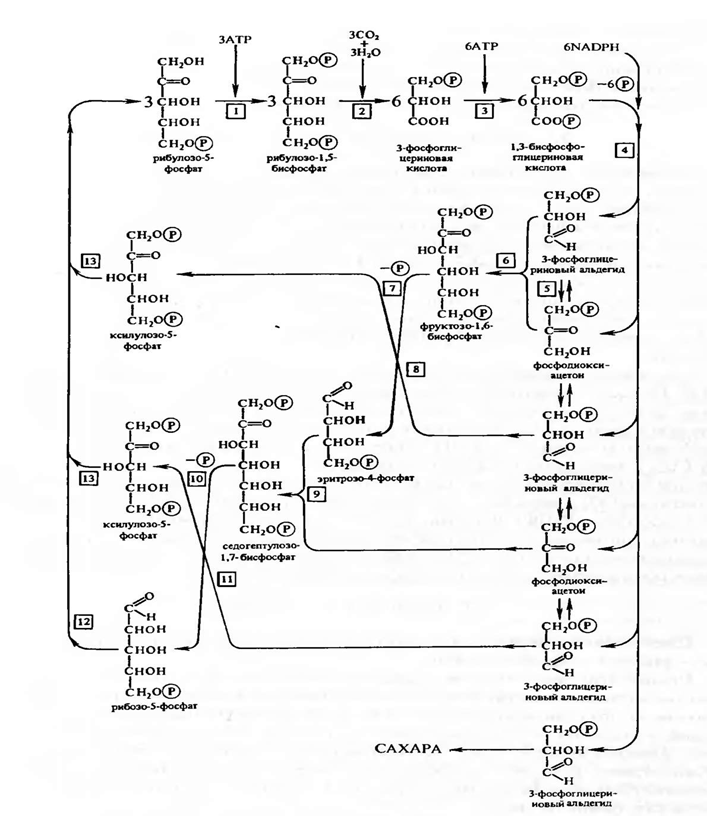
ФГА и фосфодиоксиацетон конденсируются с образованием фруктозо-1,6-дифосфата, у которого отщепляется один фосфат с помощью фруктозо-1,6- дифосфатазы. В дальнейших реакциях, связанных с регенерацией первичного акцептора С02, последовательно принимают участие транскетолаза и альдолаза. Транскетолаза катализирует перенос содержащего два углерода гликолевого альдегида от кетозы на, альдозу.
Альдолаза затем осуществляет перенос трехуглеродного остатка фосфодиоксиацетона на альдозу, в данном случае на эритрозо-4-фосфат, в результате чего синтезируется седо- гептулозо-1,7-Дифосфат. Последний дефосфорилируется и под действием транскетолазы из него и 3-ФГА образуются ксилулозо-5-фосфат и рибозо-5-фосфат. Две молекулы ксилуло- зо-5-фосфата при участии рибулозофосфатэпимеразы и одна молекула рибозо-5-фосфата с участием рибозофосфатизомеразы превращаются в три молекулы рибулозо-5-фосфата, с которого начинается новый цикл фиксации С02.
Из оставшейся неиспользованной 6-й молекулы 3-ФГА под действием альдолазы синтезируется (при повторении цикла) молекула фруктозо-1,6-дифосфата, из которой могут образовываться глюкоза, сахароза или крахмал.
Таким образом, для синтеза одной молекулы глюкозы в цикле Кальвина необходимы 12 NADPH и 18 АТР (рис. 3.13), которые поставляются в результате фотохимических реакций фотосинтеза. .
С4 путь фиксации СО2.
В работах А. Незговоровой (1956-1957 гг.), было установлено, что при коротких экспозициях листьев кукурузы на свету 14С из 14С02 обнаруживается в аспарагиновой кислоте. В дальнейших исследованиях как советских, так и зарубежных специалистов эти представления были развиты, что привело к открытию Сл-пути углерода в фотосинтезе. Так, в 1960 г. Ю. С. Карпилов, а в 1963 г. И. А. Тар- чевский и Ю. С. Карпилов представили данные о раннем образовании яблочной кислоты в листьях кукурузы. Г. П. Корчак и др. (Kortschak et al., 1965) впервые показали, что дикар- боновые кислоты (яблочная и аспарагиновая) являются первичными продуктами фиксации С02 у сахарного тростника. Затем эти соединения через 3-ФГК и гексозофосфаты превращаются в сахара. Как новый тип фиксации С02, принципиально отличающийся от цикла Кальвина, этот цикл впервые описали австралийские ученые М. Д. Хетч и К. Р. Слэк (1966). К группе растений с С4-путем фотосинтеза относятся сахарный тростник, кукуруза, сорго и др. Листья этих растений содержат два разных типа хлоропластов: хлоропласты обычного вида — в клетках мезофилла и
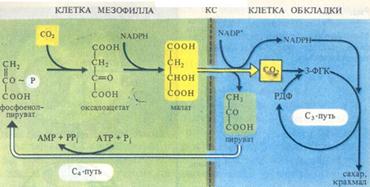
большое количество крупных хлоропластов, часто не имеющих гран, — в клетках, окружающих проводящие пучки (обкладка). С02, диффундирующий в лист через устьица, попадает в цитоплазму клеток мезофилла, где при участии ФЕП-карбокси- лазы вступает в реакцию с ФЕП, образуя щавелево- уксусную кислоту (оксалоацетат). Затем уже в хлоропластах оксалоацетат восстанавливается до яблочной кислоты (малата) за счет NADPH, образующего в ходе световой фазы фотосинтеза (рис. 3.14). Щавелевоуксусная кислота в присутствии NH4 может превращаться также в аспартат. Затем малат (или аспартат) переносится в хлоропласты клетки обкладки сосудистого пучка, где он декарбоксилируется малик-энзимом (малатдегидрогеназой декарбоксилируюшей) до пирувата и С02.
Как уже отмечалось, в хлоропластах обкладки отсутствуют граны, а следовательно, слабо представлена ФС II, необходимая для нециклического транспорта электронов, однако в них в изобилии накапливается крахмал. Объясняется это тем, что в хлоропластах обкладки используется поставляемый малик- энзимом NADPH, а также тот С02, который образовался при окислительном декарбоксилировании малата (или аспар- тата). В этих хлоропластах в процессе циклического фотофосфорилирования синтезируется большое количество АТР и фиксация С02 осуществляется по типу цикла Кальвина. У некоторых растений с С4-путем фотосинтеза (амарант, лебеда) яблочная кислота декарбоксилируется в митохондриях клеток обкладки с восстановлением NAD.
Возникающий при расщеплении малата в хлоропластах клеток обкладки пируват перемещается назад в хлоропласты клеток мезофилла (рис. 3.14), где может снова превращаться в первичный акцептор С02 — ФЕП. Такая компартментация процессов позволяет растениям с С4-путем осуществлять фотосинтез даже при закрытых устьицах, так как хлоропласты клеток обкладки используют малат (аспартат), образовавшийся ранее, как донор С02. С4-растения могут также использовать С02, возникающий при фотодыхании (см. дальше). Закрывание устьичных отверстий в наиболее жаркое время дня сокращает потери воды за счет испарения (транспирации). Не удивительно поэтому, что к С4-растениям относятся многие виды засушливой тропической зоны. Растения с С4- путем фотосинтеза, как правило, устойчивы к засолению. Эффективность использования воды, т. е. отношение массы ассимилированного С02 к массе воды, израсходованной при транспирации, у С4-растений зачастую вдвое выше, чем у С3-растений. Таким образом, С4-растения имеют преимущества перед С3-растениями в засушливых местах обитания благодаря высокой интенсивности фотосинтеза даже при закрытых устьицах. Фиксация С02 с участием ФЕП и образование малата (аспартата) служит как бы насосом для поставки С02 в хлоропласты обкладки, функционирующие по С3-пути.
Фотосинтез по типу Толстянковых. Суккуленты (роды Crassula, Bryophyllum и др.) приспособились осуществлять фотосинтез в условиях резко засушливого климата. Для них характерен суточный цикл метаболизма С4-кислот с образованием яблочной кислоты ночью.
«В соответствии с английским выражением crassulacean acid metabolism (САМ) этот тип фотосинтеза часто сокращенно называют САМ-метаболизм. Устьица этих растений днем обычно закрыты, что предотвращает потерю воды, и открываются ночью. С02 поступает в листья, где при участии содержащейся в цитоплазме ФЕП-карбоксилазы взаимодействует с фосфоенолпируватом, образуя оксалоацетат. Источником ФЕП служит крахмал. То же самое происходит и с С02, который освобождается в клетках в процессе дыхания. Образовавшийся оксалоацетат восстанавливается под действием NADH-зависи.мой малатдегидрогеназы до яблочной кислоты, которая накапливается в вакуолях клеток листа (рис.). Это приводит к закислению клеточного сока в ночное время. Как и у С4-растений, оксалоацетат может быть источником аспартата, однако этот путь здесь менее выражен.
Днем в условиях высокой температуры, когда устьица закрыты, малат транспортируется из вакуолей в цитоплазму и там декарбоксилируется при участии малатдегидрогеназы декарбоксилирующей (малик-энзима) с образованием С02 и пирувата. С02 поступает в хлоропласты и включается в них в цикл Кальвина, участвуя в синтезе Сахаров.
Таким образом, у растений с фотосинтезом по типу толстянковых много общего с С4-путем фотосинтеза. Однако при САМ-мстаболизме фиксация С02 с образованием малата (ночью) и декарбоксилироваиие малата с высвобождением СО, и пирувата (днем) разделены во времени. У С4-расгений эти же реакции разграничены в пространстве: первая протекает в хлоропластах мезофилла, вторая - в клетках обкладки. При достаточном количестве воды ряд растений с метаболизмом по типу толстянковых могут вести себя как С3-растсния. В свою очередь некоторые растения с С3-путем фотосинтеза при недостатке воды проявляют черты САМ-метаболизма.
В растительных клетках, содержащих хлоропласты, помимо С3- и С4-путей фотосинтеза, осуществляется также фотодыхание, т. с. активируемый светом процесс высвобождения СО2, и поглощения О2,, который значительно отличается от «темнового» дыхания митохондрий. Так как при этом первичным продуктом является гликолевая кислота, то этот путь получил название гликолатного. У .некоторых С3-растений с малой эффективностью фотосинтеза интенсивность фотодыхания может достигать 50% от интенсивности фотосинтеза.
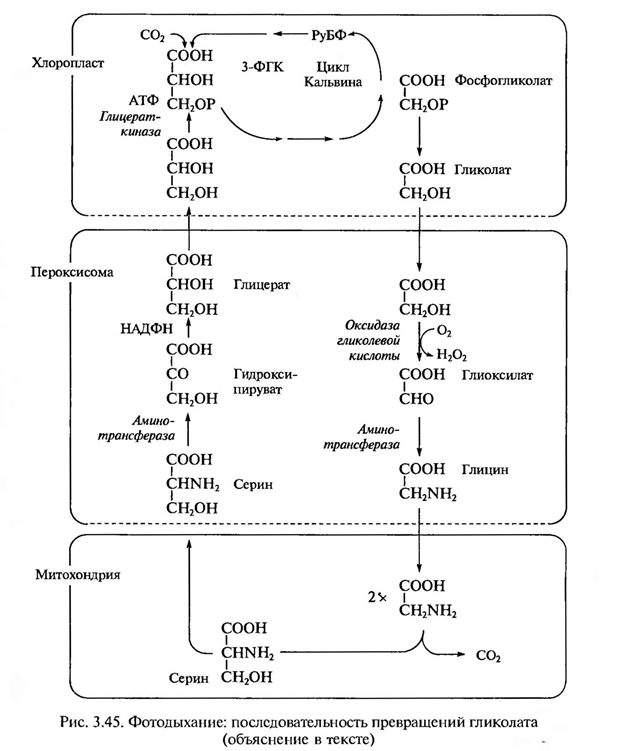
Фотодыхание у C3-растений обычно усиливается при низком содержании С02 и высоких концентрациях 02. В этих условиях РДФ-карбоксилаза в хлоропластах может функционировать как оксигеназа, катализируя окислительное расщепление рибулозо-1,5-дифосфата на 3-ФГК и 2-фосфогликолевую кислоту, которая затем дефосфорилируется в гликолевую кислоту (рис.). Молекулы С02 и 02 конкурируют между собой в каталитическом центре РДФ-карбоксилазы: при относительно высоких концентрациях С02 и низких 02 преобладает карбоксилирование, тогда как высокие концентрации 02 и низкое содержание СО2, благоприятствуют окислению, а следовательно, и образованию фосфогликолевой кислоты. В том же направлении действует и повышение температуры.
Фотодыхание осуществляется в результате взаимодействия трех органелл — хлоропластов. пероксисом и митохондрий (рис.). Гликолат из хлоропласта поступает в пероксисому и там окисляется гликолатоксидазой до глиоксилата. Возникающая перекись водорода устраняется каталазой пероксисомы. Глиоксилат аминируется, превращаясь в глицин, причем в качестве донора аминогруппы функционирует глутамат.
Глицин транспортируется в митохондрию. Здесь из двух молекул глицина образуется серии и освобождается С02. Теперь цикл замыкается: серин может снова поступать в пероксисому и там передать свою аминогруппу на пируват. При этом из пирувата возникает аланин, из серина — гидроксипируват, который сразу после этого восстанавливается вглицерат. Затем глицерат может снова попасть в хлоропласты и благодаря фосфорилированию включиться в цикл Кальвина.
Последовательность реакций фотодыхания не обязательно образует цикл. Гликолатный путь С3-растений может завершиться в митохондриях. Конечными продуктами в этом случае являются серин и С02. Освобождение С02 объясняет, почему нетто-фотосинтез (чистая продуктивность) при интенсивном фотодыхании снижается (рис.).
У С4-расгений С02, выделяющийся в результате фотодыхания, перехватывается в клетках мезофилла, где из ФЕП и С02 образуются оксалоацетат и малат. Затем малат «отдает» свой С02 хлоропластам
обкладки, где функционирует цикл Кальвина. В связи с этим становится понятным высокий нетто-фотосинтез С4-растений.
Однако для чего же тогда нужно фотодыхание? Необходимо вспомнить, что гликолатный путь приводит к синтезу глицина и серина, в пероксисомах происходит восстановление NADP+; имеются косвенные данные о том, что в процессе образования серина может генерироваться и АТР. Показано, что С3-растения, помещенные в атмосферу с низким парциальным давлением 02 и высокой концентрацией С02, ведут себя подобно С4-растениям, т. е. имеют низкий уровень фотодыхания.
Из всего сказанного можно сделать вывод, что термин фотодыхание имеет лишь формальный смысл: 02 потребляется, С02 выделяется, однако в функциональном плане к дыханию этот процесс прямого отношения не имеет.
Регуляция фотосинтеза осуществляется на уровне фотохимически активных мембран, хлоропластов, клеток, тканей, органов и целого организма. Все системы регуляции принимают участие в этом процессе.
| <== предыдущая страница | | | следующая страница ==> |
| Эффэкт Эммерсона | | | Регуляция фотосинтеза |
Дата добавления: 2014-02-28; просмотров: 1288; Нарушение авторских прав

Мы поможем в написании ваших работ!